
【题目】将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+)B.Ka(HF)C.c(F-)/c(H+)D.c(F-)/c(HF)
科目:高中化学 来源: 题型:
【题目】以乙烷燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是
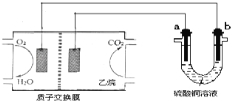
A.燃料电池工作时,正极反应为O2+2H2O+4e-═ 4OH-
B.a极是铜,b极是铁时,硫酸铜溶液浓度减小
C.a、b两极若是石墨,在同温同压下a极产生的气体与电池中消耗的乙烷体积的比为7/2
D.a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类不同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示。据图判断不正确的是
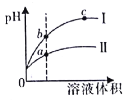
A.I是盐酸,II是醋酸
B.b点酸的总浓度大于a点酸的总浓度
C.溶液的导电性a>b>c
D.a、b、c三点KW的数值相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表实验中,对应的现象和结论都正确,且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 将少量碳酸钙粉末加入到饱和NH4Cl溶液中 | 产生气体,粉末溶解 | NH4Cl水解使溶液呈酸性 |
B | 将BaSO4固体粉末加入饱和Na2CO3溶液中,搅拌,过滤,洗涤,在滤渣中加入稀盐酸 | 产生气体,滤渣部分溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
C | 将黑色氧化铜粉末进行高温加热 | 黑色变成红色 | CuO分解生成铜单质 |
D | 将某溶液滴加过量的稀盐酸 | 有刺激性气味气体产生,溶液中出现沉淀 | 溶液中一定存在S2-和SO32- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) ![]() Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )
Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )
A. 若生成1 mol Fe,则吸收的热量小于a kJ
B. 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C. 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D. 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_____________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(![]() )________0.1 mol·L-1NH4HSO4中c(
)________0.1 mol·L-1NH4HSO4中c(![]() )。(填“等于”、“大于”或“小于”)
)。(填“等于”、“大于”或“小于”)
(3)用等式表示0.1 mol·L-1NH4Al(SO4)2溶液中各离子浓度关系____________。
(4)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
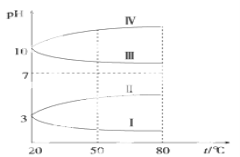
其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是_____________________________;
(5)室温时,向100 mL 0.1 mol·L-1HCl溶液中滴加0.1 mol·L-1氨水,得到溶液pH与氨水体积的关系曲线如图所示:

①试分析图中a、b、c、d四个点,水的电离程度最大的是____________;
②在b点,溶液中各离子浓度由大到小的排列顺序是__________________;
③写出a点混合溶液中下列算式的精确结果(不能近似计算):
c(Cl-)- c(NH4+)=____________,c(H+)- c(NH3·H2O)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)电化腐蚀是钢铁发生腐蚀的主要原因,当水膜氢离子浓度较小时,主要发生________腐蚀,其负极反应式为____________________,正极反应式为______________________。
(2)将氯化铁溶液蒸干灼烧得到的固体物质是______;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是___________________ 。
(3)除CaSO4水垢的方法,写出反应的化学方程式_________________、_________________;热的纯碱溶液洗涤效果更好的原理是_________________________;明矾净水的离子方程式__________________。
(4)在2 mL 0.1 mol·L-1的NaCl溶液中,加入2 mL 0.1 mol·L-1的AgNO3溶液,可观察到______________,此反应的离子方程式为_________。将此混合液过滤,滤渣加入2 mL 0.1 mol·L-1的KI溶液,搅拌,可观察到____,反应的离子方程式为________。
(5)对于Ag2S(s)![]() 2Ag+(aq)+S2-(aq),其Ksp的表达式为_______。
2Ag+(aq)+S2-(aq),其Ksp的表达式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(![]() )是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:
)是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:

(1)A的分子式是______,B含有的官能团的名称是_________。
(2)D→E的反应类型是_________。
(3)已知G能与金属钠反应,则G的结构简式为________。
(4)写出E→F的化学方程式:_________。
(5)龙胆酸D的同分异构体有多种,符合下列条件的有___种。写出其中一种核磁共振氢谱有六组峰的同分异构体的结构简式:____。
①能发生银镜反应;②与FeCl3溶液发生显色反应;③1mol该物质能与2mol Na2CO3反应。
(6)已知: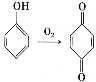 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(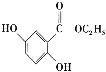 )的合成路线(无机试剂任用)。_________
)的合成路线(无机试剂任用)。_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com