
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示。据图判断不正确的是
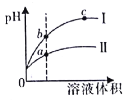
A.I是盐酸,II是醋酸
B.b点酸的总浓度大于a点酸的总浓度
C.溶液的导电性a>b>c
D.a、b、c三点KW的数值相同
科目:高中化学 来源: 题型:
【题目】在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )
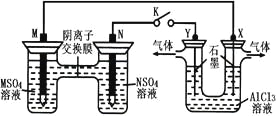
A.溶液中c(M2+)减小
B.N的电极反应式:N-2e-=N2+
C.X电极上有H2产生,发生还原反应
D.反应过程中Y电极周围生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型动力电池( LiFePO4电池)总反应式为Li1-xFePO4+LixC6![]() C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是
C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是

A. 电池放电时,LixC6在负极发生氧化反应
B. 电池放电时,正极反应式为 Lil-xFePO4+xLi-+xe-= LiFePO4
C. 电解时,图2的b电极反应式为2H2O-4e-=O2↑+4H+
D. 电解时,当转移0.2mol电子,A口产生气体的质量1.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4P(红磷,s)![]() P4(白磷,s)△H=+17kJ·mol-l,下列推论正确的是
P4(白磷,s)△H=+17kJ·mol-l,下列推论正确的是
A.当1mol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.白磷热稳定性比红磷大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:
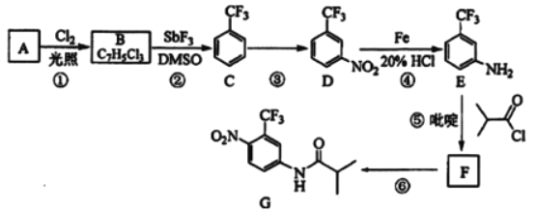
回答下列问题:
(1)A的结构简式为__。C的化学名称是__。
(2)③的反应试剂和反应条件分别是__,该反应的类型是__。
(3)⑤的反应方程式为__。吡啶是一种有机碱,其作用是__。
(4)G的分子式为__。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有__种。
(6)4甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。
)制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1500moVL标准盐酸测定某未知浓度的NaOH溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗碱式滴定管
C.用碱式滴定管取NaOH溶液25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否湍水
F.取下酸式滴定管用标准盐酸润洗后,将标准液注入酸式滴定管“0"刻度以上2~3cm处,再把酸式滴定管固定好,调节液面至0"刻度或“0"刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用字母填写)____________________
(2)本实验中对滴定管的操作如下图所示,正确的是______________(填字母)。

(3)判断到达滴定终点的现象是________________________________________
滴定结果如下表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该NaOH溶液的物质的量浓度为_____________mol/L
(4)下列操作会导致测定结果偏高的是________
A.酸式滴定管在装液前未用标准盐酸润洗
B.滴定过程中,锥形瓶摇晃的太剧烈,锥形瓶内有液体溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+)B.Ka(HF)C.c(F-)/c(H+)D.c(F-)/c(HF)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
A. 已知25 ℃时NH4CN溶液显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
B. 室温时, 相同体积、相同pH的盐酸和醋酸溶液中由水电离出的c(H+):盐酸小于醋酸溶液
C. 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时, CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨(NH2OH)为一元弱碱(25℃时,电离常数Kb=9.0×10—9),其电离方程式为:NH2OH+H2O ![]() NH3OH++OH-。在25℃时,用0.l0mol/L盐酸滴定20mL0.10mol/LNH2OH溶液,滴定过程中由水电离出来的H+浓度的负对数[-lgc水(H+)]与盐酸体积(V)的关系如图所示。(已知:lg3=0.5)
NH3OH++OH-。在25℃时,用0.l0mol/L盐酸滴定20mL0.10mol/LNH2OH溶液,滴定过程中由水电离出来的H+浓度的负对数[-lgc水(H+)]与盐酸体积(V)的关系如图所示。(已知:lg3=0.5)
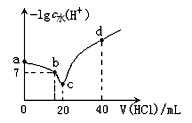
下列说法中错误的是
A.a点对应溶液的pH=9.5
B.c点溶液中存在离子反应: NH3OH++H2O ![]() NH2OH+H3O+
NH2OH+H3O+
C.d点溶液中:—lgc水(H+)=13
D.b点对应的溶液中有:c(NH3OH+)=c(Cl—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com