
【题目】羟氨(NH2OH)为一元弱碱(25℃时,电离常数Kb=9.0×10—9),其电离方程式为:NH2OH+H2O ![]() NH3OH++OH-。在25℃时,用0.l0mol/L盐酸滴定20mL0.10mol/LNH2OH溶液,滴定过程中由水电离出来的H+浓度的负对数[-lgc水(H+)]与盐酸体积(V)的关系如图所示。(已知:lg3=0.5)
NH3OH++OH-。在25℃时,用0.l0mol/L盐酸滴定20mL0.10mol/LNH2OH溶液,滴定过程中由水电离出来的H+浓度的负对数[-lgc水(H+)]与盐酸体积(V)的关系如图所示。(已知:lg3=0.5)
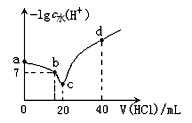
下列说法中错误的是
A.a点对应溶液的pH=9.5
B.c点溶液中存在离子反应: NH3OH++H2O ![]() NH2OH+H3O+
NH2OH+H3O+
C.d点溶液中:—lgc水(H+)=13
D.b点对应的溶液中有:c(NH3OH+)=c(Cl—)
【答案】C
【解析】
A. a点时,c(OH-)=![]() =
=![]() =3.0×10-5mol/L,对应溶液的pH=9+lg3=9.5,A正确;
=3.0×10-5mol/L,对应溶液的pH=9+lg3=9.5,A正确;
B. c点时,NH2OH与HCl刚好完全反应,生成NH3OHCl,在溶液中发生下列水解反应: NH3OH++H2O ![]() NH2OH+H3O+,B正确;
NH2OH+H3O+,B正确;
C. d点时,溶液中的溶质为0.002molHCl和0.002mol NH3OHCl,此时溶液体积为60mL,溶液中的c(H+)=![]() mol/L,水电离出的c(H+)=3×10-13mol/L,-lgc水(H+)=12.5,C错误;
mol/L,水电离出的c(H+)=3×10-13mol/L,-lgc水(H+)=12.5,C错误;
D. b点对应的溶液中溶质为NH3OHCl和NH2OH,由于pH=7,根据电荷守恒可知,c(NH3OH+)=c(Cl-),D正确。
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示。据图判断不正确的是
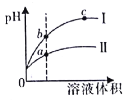
A.I是盐酸,II是醋酸
B.b点酸的总浓度大于a点酸的总浓度
C.溶液的导电性a>b>c
D.a、b、c三点KW的数值相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)电化腐蚀是钢铁发生腐蚀的主要原因,当水膜氢离子浓度较小时,主要发生________腐蚀,其负极反应式为____________________,正极反应式为______________________。
(2)将氯化铁溶液蒸干灼烧得到的固体物质是______;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是___________________ 。
(3)除CaSO4水垢的方法,写出反应的化学方程式_________________、_________________;热的纯碱溶液洗涤效果更好的原理是_________________________;明矾净水的离子方程式__________________。
(4)在2 mL 0.1 mol·L-1的NaCl溶液中,加入2 mL 0.1 mol·L-1的AgNO3溶液,可观察到______________,此反应的离子方程式为_________。将此混合液过滤,滤渣加入2 mL 0.1 mol·L-1的KI溶液,搅拌,可观察到____,反应的离子方程式为________。
(5)对于Ag2S(s)![]() 2Ag+(aq)+S2-(aq),其Ksp的表达式为_______。
2Ag+(aq)+S2-(aq),其Ksp的表达式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向某容积恒定的密闭容器中充入1 mol N2、3 mol H2,经充分反应后达到如下平衡:N2(g)+3H2(g)![]() 2NH3(g),下列有关说法中正确的是( )
2NH3(g),下列有关说法中正确的是( )
A. 达平衡后再加入一定量的N2,体系内各物质含量不变
B. N2、H2、NH3的浓度一定相等
C. 反应没有达到平衡时,NH3会不断地分解,达到平衡时则不会再分解
D. 平衡时,N2、H2物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+3B(g)=2C(g)+D(g),经2min,B的浓度减少0.6 molL-1。对此反应速率的表示正确的是( )
①用A表示的反应速率是0.4 molL-1min-1
②分别用B、C、D表示的反应速率其比值为3:2:1
③在2 min末的反应速率,用B表示是0.3 molL-1min-1
④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的
A. ①②
B. ③
C. ①
D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组在实验室模拟工业制备硫氰化钾(KSCN),实验装置如图所示。
实验步驟如下:
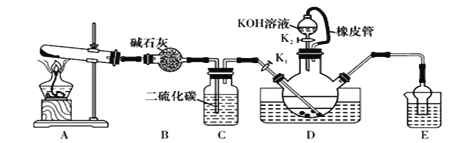
(1)制备NH4SCN溶液:CS2+2NH3![]() NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2
NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2
①实验前,应进行的操作是________________________。三颈烧瓶内盛放有一定量的CS2、水和催化剂,三颈烧瓶的下层CS2液体必须浸没导气管口,目的是_____________________。
②实验开始时打开K1,加热装置A、D,缓慢地向装置D中充入气体。装置A中发生反应的化学方程式是______________________________,装置C的作用可能是_______________。
(2)制备KSCN溶液:移去装置A处的酒精灯,关闭K1,打开K2,利用耐碱分液漏斗边加液边加热,则此时装置D中发生反应的化学方程式是____________________。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶,__________________,得到硫氰化钾晶体。
(4)测定KSCN的含量:称取10.00g样品配成1000mL溶液,量取20.00mL溶液于锥形瓶中,并加入几滴Fe(NO3)3溶液,用0.1000 mol/L AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,则终点时的现象是________________。
②KSCN的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(![]() )是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:
)是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:

(1)A的分子式是______,B含有的官能团的名称是_________。
(2)D→E的反应类型是_________。
(3)已知G能与金属钠反应,则G的结构简式为________。
(4)写出E→F的化学方程式:_________。
(5)龙胆酸D的同分异构体有多种,符合下列条件的有___种。写出其中一种核磁共振氢谱有六组峰的同分异构体的结构简式:____。
①能发生银镜反应;②与FeCl3溶液发生显色反应;③1mol该物质能与2mol Na2CO3反应。
(6)已知: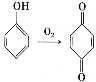 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(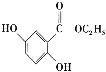 )的合成路线(无机试剂任用)。_________
)的合成路线(无机试剂任用)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传感器可以检测空气中SO2的含量,传感器工作原理如下图所示。下列叙述正确的是( )

A.b为电源的正极
B.负极反应式 Ag - e- + Cl- = AgCl
C.当电路中电子转移为5×10-5 mol时进入传感器的SO2为 1.12 mL
D.阴极的电极反应式是2HSO3-+2H++2e-= S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是

A. K与N连接时,X为硫酸,一段时间后溶液的pH增大
B. K与N连接时,X为氯化钠,石墨电极反应:2H++2e-=H2↑
C. K与M连接时,X为硫酸,一段时间后溶液的pH增大
D. K与M连接时,X为氯化钠,石墨电极反应:4OH--4e-=2H2O+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com