
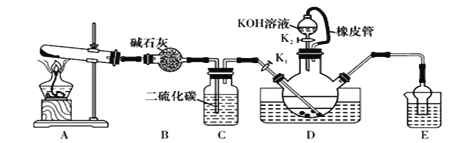
【题目】某校化学兴趣小组在实验室模拟工业制备硫氰化钾(KSCN),实验装置如图所示。
实验步驟如下:
(1)制备NH4SCN溶液:CS2+2NH3![]() NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2
NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2
①实验前,应进行的操作是________________________。三颈烧瓶内盛放有一定量的CS2、水和催化剂,三颈烧瓶的下层CS2液体必须浸没导气管口,目的是_____________________。
②实验开始时打开K1,加热装置A、D,缓慢地向装置D中充入气体。装置A中发生反应的化学方程式是______________________________,装置C的作用可能是_______________。
(2)制备KSCN溶液:移去装置A处的酒精灯,关闭K1,打开K2,利用耐碱分液漏斗边加液边加热,则此时装置D中发生反应的化学方程式是____________________。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶,__________________,得到硫氰化钾晶体。
(4)测定KSCN的含量:称取10.00g样品配成1000mL溶液,量取20.00mL溶液于锥形瓶中,并加入几滴Fe(NO3)3溶液,用0.1000 mol/L AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,则终点时的现象是________________。
②KSCN的质量分数为______________________。
【答案】检查装置的气密性 防止发生倒吸现象 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 通过观察C中产生气泡的速率,控制加热的温度 NH4SCN+KOH
CaCl2+2NH3↑+2H2O 通过观察C中产生气泡的速率,控制加热的温度 NH4SCN+KOH![]() KSCN+NH3↑+H2O 过滤、洗涤、干燥 当滴入最后一滴标准溶液时,溶液的血红色恰好消失(褪去),且半分钟内不恢复原色 97%
KSCN+NH3↑+H2O 过滤、洗涤、干燥 当滴入最后一滴标准溶液时,溶液的血红色恰好消失(褪去),且半分钟内不恢复原色 97%
【解析】
(1)①实验前,应检查装置是否漏气。三颈烧瓶的下层CS2液体必须浸没导气管口,若不浸没导管口,则必然与水接触,从氨在水中的溶解程度进行分析。
②装置A是制取氨气的装置,药品为NH4Cl与Ca(OH)2。因这氨气不溶于CS2,反应缓慢,所以需缓慢通入,装置C的作用,从如何让氨气“缓慢”通入考虑。
(2)制备KSCN溶液:装置D中,NH4SCN与KOH反应,生成KSCN等。
(3)制备KSCN晶体:减压蒸发浓缩,冷却结晶,应将晶体从溶液中提取出来,然后再去除表面杂质,以获得硫氰化钾晶体。
(4) ①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,起初溶液为红色,后来变为无色,由此得出终点时的现象。
② 由反应SCN-+Ag+= AgSCN↓,可得出n(KSCN)=n(AgNO3),代入数据,便可求出KSCN的质量分数。
(1)①实验前,应进行的操作是检查装置的气密性。因为氨气极易溶于水,所以通氨气的导管口不能插入水层,从而得出三颈烧瓶的下层CS2液体必须浸没导气管口的原因是防止发生倒吸现象。答案为:检查装置的气密性;防止发生倒吸现象;
②装置A是制取氨气的装置,药品为NH4Cl与Ca(OH)2,发生反应的化学方程式是2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,因为氨气不溶于CS2,所以与CS2反应缓慢,应缓慢通气,从而得出装置C的作用可能是通过观察C中产生气泡的速率,控制加热的温度。答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,因为氨气不溶于CS2,所以与CS2反应缓慢,应缓慢通气,从而得出装置C的作用可能是通过观察C中产生气泡的速率,控制加热的温度。答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;通过观察C中产生气泡的速率,控制加热的温度;
CaCl2+2NH3↑+2H2O;通过观察C中产生气泡的速率,控制加热的温度;
(2)制备KSCN溶液:装置D中,NH4SCN与KOH反应,生成KSCN等,发生反应的方程为NH4SCN+KOH![]() KSCN+NH3↑+H2O。答案为:NH4SCN+KOH
KSCN+NH3↑+H2O。答案为:NH4SCN+KOH![]() KSCN+NH3↑+H2O;
KSCN+NH3↑+H2O;
(3)制备KSCN晶体:减压蒸发浓缩,冷却结晶,过滤、洗涤、干燥,以获得硫氰化钾晶体。答案为:过滤、洗涤、干燥;
(4) ①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,则终点时的现象是当滴入最后一滴标准溶液时,溶液的血红色恰好消失(褪去),且半分钟内不恢复原色。答案为:当滴入最后一滴标准溶液时,溶液的血红色恰好消失(褪去),且半分钟内不恢复原色;
② 由反应SCN-+Ag+= AgSCN↓,可得出n(KSCN)=n(AgNO3)=0.1000mol/L×0.02L
=0.002mol,KSCN的质量分数为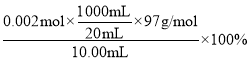 =97%。答案为:97%。
=97%。答案为:97%。


科目:高中化学 来源: 题型:
【题目】某学生用0.1500moVL标准盐酸测定某未知浓度的NaOH溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗碱式滴定管
C.用碱式滴定管取NaOH溶液25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否湍水
F.取下酸式滴定管用标准盐酸润洗后,将标准液注入酸式滴定管“0"刻度以上2~3cm处,再把酸式滴定管固定好,调节液面至0"刻度或“0"刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用字母填写)____________________
(2)本实验中对滴定管的操作如下图所示,正确的是______________(填字母)。

(3)判断到达滴定终点的现象是________________________________________
滴定结果如下表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该NaOH溶液的物质的量浓度为_____________mol/L
(4)下列操作会导致测定结果偏高的是________
A.酸式滴定管在装液前未用标准盐酸润洗
B.滴定过程中,锥形瓶摇晃的太剧烈,锥形瓶内有液体溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[FeSO4·(NH4)2SO4·6H2O]是一种能溶于水、难溶于酒精的浅蓝绿色晶体,常用于定量分析中配制亚铁离子的标准溶液,实验室用下图所示装置制备摩尔盐。下列说法错误的是

A.铁屑上的少量油污可用煮沸的饱和Na2CO3溶液洗涤,再用蒸馏水洗净
B.用标准摩尔盐滴定酸性KMnO4溶液时不需要外加指示剂
C.实验开始阶段产生的气体是用来排出装置内的空气
D.实验开始时应先打开K1、K3,关闭K2;待a中反应即将完成时,再打开K2,关闭K1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质E(普鲁卡因)作为局部麻醉剂,在传导麻醉、浸润麻醉及封闭疗法中均有良好疗效。它的合成路线如下:

回答下列问题:
(1)A的结构简式为____________,生成C的反应类型为__________________。
(2)D中含氧官能团的名称为______________________。
(3)反应1需加入的无机试剂为_____________________。
(4)一定条件下,E的水解产物之一F能发生自身缩聚,写出该缩聚反应的化学方程式:_____________________________________。F的同分异构体中,遇FeC13溶液显色且能发生银镜反应的共有______种,其中苯环上的一取代物有两种的结构简式为__________。
(5)参照上述合成路线,设计以CH3—CH=CH2为原料(其他试剂任选),制备![]() 的合成路线_______________。
的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨(NH2OH)为一元弱碱(25℃时,电离常数Kb=9.0×10—9),其电离方程式为:NH2OH+H2O ![]() NH3OH++OH-。在25℃时,用0.l0mol/L盐酸滴定20mL0.10mol/LNH2OH溶液,滴定过程中由水电离出来的H+浓度的负对数[-lgc水(H+)]与盐酸体积(V)的关系如图所示。(已知:lg3=0.5)
NH3OH++OH-。在25℃时,用0.l0mol/L盐酸滴定20mL0.10mol/LNH2OH溶液,滴定过程中由水电离出来的H+浓度的负对数[-lgc水(H+)]与盐酸体积(V)的关系如图所示。(已知:lg3=0.5)
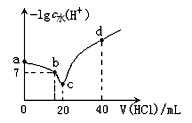
下列说法中错误的是
A.a点对应溶液的pH=9.5
B.c点溶液中存在离子反应: NH3OH++H2O ![]() NH2OH+H3O+
NH2OH+H3O+
C.d点溶液中:—lgc水(H+)=13
D.b点对应的溶液中有:c(NH3OH+)=c(Cl—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
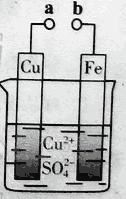
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) ΔH1
O2(g)=H2O(g) ΔH1
![]() N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+O2(g)=NO2(g) ΔH2
![]() N2(g)+3/2H2(g)=NH3(g) ΔH3
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3D. 3ΔH1+2ΔH2-2ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
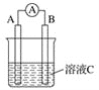
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
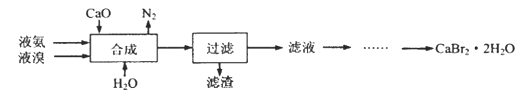
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
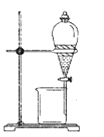
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。
(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com