
(8分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水生成Zn(NH3)22+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表达)。 (2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式____________________________________________。 试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因___________________________。
(1)AlO2-[或Al(OH)4-] (1分)
(2)Zn+2NaOH═Na2ZnO2+H2↑[或Zn+2NaOH+2H2O═Na2Zn(OH)4+H2↑] (2分)。
(3)①③④ (2分) (4)Al3++3NH2·H2O═Al(OH)3↓+3NH4+ (2分)。可溶性锌盐与氨水反应产生的Zn(OH)2可溶液过量氨水中,生成Zn(NH3)42+,氨水的用量不易控制(1分)
解析试题分析:(1)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,溶液中铝元素的存在形式为AlO2-或Al(OH)4-。
(2)由于锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。实验可依据铝与氢氧化钠溶液反应得出锌与氢氧化钠溶液反应的方程式,即为Zn+2NaOH=Na2ZnO2+H2↑或Zn+2NaOH+2H2O=Na2Zn(OH)4+H2↑。
(3)硫酸铝滴入到氢氧化钠溶液中,开始没有白色沉淀产生。但氢氧化钠完全反应后再滴加硫酸铝开始出现白色沉淀氢氧化铝。如果把氢氧化钠溶液滴入到硫酸铝溶液中立即出现白色沉淀氢氧化铝,可以鉴别;由于氢氧化铝不能溶于弱碱氨水中,因此硫酸铝和氨水不论怎么相互滴加,都是产生白色沉淀,不能鉴别;由于氢氧化锌的性质类似于氢氧化铝,所以硫酸锌和氢氧化钠溶液相互滴加顺序不同时实验现象不同,可以鉴别;由于氢氧化锌能溶于氨水中,所以硫酸锌滴入到氨水中开始得不到沉淀,而氨水滴入到硫酸锌溶质中立即出现白色沉淀氢氧化锌,实验现象不同,可以鉴别,答案选①③④。
(4)由于氢氧化铝不能溶于弱碱氨水中,因此可溶性铝盐与氨水反应的离子方程式为Al3++3NH2·H2O=Al(OH)3↓+3NH4+;由于氢氧化锌钠溶于弱碱氨水中,因此可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成Zn(NH3)42+,氨水的用量不易控制,所以实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌。
考点:考查铝、锌、氢氧化铝、氢氧化锌的性质;物质的鉴别与制备


科目:高中化学 来源: 题型:填空题
以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐:4CuFeS2+2H2SO4+17O2 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下: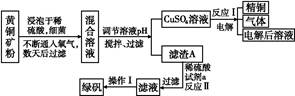
回答下列问题:
(1)下列物质中可以用于上述流程中调节溶液pH的是 (填序号)。
| A.Cu; | B.Cu2(OH)2CO3; | C.H2SO4; | D.Fe;E.CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
(1)酸浸后加入H2O2的目的是 。调pH步骤中加入的试剂最好是 (填化学式)。实验室进行过滤操作所用到的玻璃仪器有 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式 。
(3)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数 。
(4)Fe3+发生水解反应Fe3++3H2O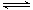 Fe(OH)3+3H+,该反应的平衡常数表达式为 。
Fe(OH)3+3H+,该反应的平衡常数表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某不锈钢(主要成分为Fe)样品中含有铝、铜等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:
(1)滤液C中溶质含有_ _(写化学式);
(2)如何验证滤液A中含Fe2+,而不含Fe3+____ _____。
(3)对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素质量分数的表达式为(用含a、b的式子表示)___ __。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业制钛白粉产生的废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生产补血剂乳酸亚铁。其生产流程如下:
已知:TiOSO4可溶于水,在水中电离为TiO2+和SO42-。请回答下列问题:
(1)写出TiOSO4水解生成钛酸H4TiO4的离子方程式 。步骤①中加入足量铁屑的目的是 。
(2)工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法(剑桥法)生产钛 是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_______________。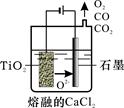
(3)步骤②的离子方程式是 ,所得副产品主要 是__________(填化学式)。
(4)步骤④的结晶过程中必须控制一定的真空度,原因是 。
(5)乳酸可由乙烯经下列步骤合成:
上述合成路线的总产率为60%,乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生产468 kg乳酸亚铁晶体(M=234 g/mol)需要标准状况下的乙烯 m3。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: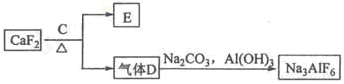
回答下列问题:
(1)写出反应1的离子方程式 , ,
(2)滤液Ⅰ中加入CaO生成的沉淀是 (填化学式),反应2(气体A足量)的离子方程式为 ;
(3)电解制铝的化学方程式是 ;
(4)C为浓硫酸,E为硫酸钙,写出由D制备冰晶石(有A生成)的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用含有Al2O3及少量Fe2O3和SiO2的铝土矿制备净水剂——液体聚合硫酸铝铁,工艺流程如下(部分操作和条件略):
I.向铝土矿中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
(1)Fe2O3与H2SO4反应的离子方程式是___________。
(2)步骤I中过滤得到的滤渣成分是________(填化学式)。
(3)步骤I 中H2SO4的浓度与反应温度会影响铁与铝的浸出率。根据下图分析,步骤I 中H2SO4浓度的适宜范围是__________,反应的适宜温度是_________。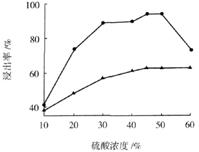

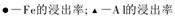
(4)步骤II中增大n(Fe3+)的离子方程式是_________。
(5)步骤III得到碱式硫酸铝铁[AlFe(OH)n(SO4)m]的溶液,则步骤II中应增大n(Fe3+)到
n(Al3+)﹕n(Fe3+)= 。
(6)研究表明,液体聚合硫酸铝铁的纯度越高,净水效果越好。已知:
一些物质在20℃时的溶解度
| 物质 | Ca(OH)2 | CaSO4 | Na2SO4 |
| 溶解度/g | 0.153 | 0.258 | 19.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO32-、Cl-、NO3-等离子中的若干种。现做如下实验:
一、取少量该溶液,滴入用硝酸酸化的AgNO 3溶液,有白色沉淀生成。
二、另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用下图表示。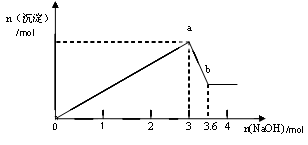
试推断:
(1)该溶液中一定存在__________ ____,一定不存在________________。
(2)由图可知白色沉淀共有__________种,分别是__________________(填化学式),其物质的量比为 。
(3) 写出图中a b变化过程的离子方程式 。
b变化过程的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。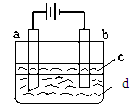
(1)b电极材料为______,其电极反应式为_____________________。
(2)(选择填空)电解时,当在电极上有白色沉淀生成时,电解液d是_____;当在两极之间的溶液中有白色沉淀生成时,电解液d是______。
| A.纯水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com