
以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐:4CuFeS2+2H2SO4+17O2 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下: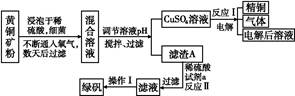
回答下列问题:
(1)下列物质中可以用于上述流程中调节溶液pH的是 (填序号)。
| A.Cu; | B.Cu2(OH)2CO3; | C.H2SO4; | D.Fe;E.CuO |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为________。电解粗铜制取精铜,电解时,阳极材料是________,电解液中必须含有的阳离子是________。
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4为________mol。
(3)电子工业曾用质量分数为30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到FeCl3溶液,设计如下实验流程。
上述流程中,所加试剂的化学式为:X________,Y________,Z________;第⑥步反应的离子方程式为
___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金。
(1)快中子反应堆的热交换剂用的是钠钾合金,其常温下是 态(填气、液、固)。把钠的物质的量分数为20%的0.2mol的此合金安全地加入到重水(D2O)中,产生的气体物质所含的中子数为 。
(2)镁铝合金是经常见到的轻质合金。剪一块合金在空气中燃烧,除生成MgO和Al2O3外,最有可能生成的第三种物质的电子式是 。当一块5.1g的镁铝合金薄片溶于3.6 mol·L-1的200ml 的硫酸溶液中,至少需加入1 mol·L-1的氢氧化钠溶液的体积 mL至沉淀质量不再改变,如整个过程中有0.5mol 的电子发生转移,则合金中Mg的物质的量分数为 。
(3)①有一种铜的合金即黄铜(可看作是Cu和Zn),可分别用酸溶法或碱溶法来分离该两种金属,其中把该合金投入到稀盐酸中,发现产生气泡的速度比用锌与盐酸反应制氢气的速度快,其原因是 。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合下图信息推断该合金中除铜外一定含有 。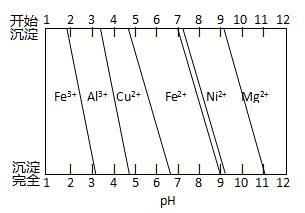
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液 B.紫色石蕊溶液
C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为_____________________________。
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三脚架、泥三角,还需要的仪器有________________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80 ℃,目的是______________________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。
①用分析天平称取2.700 g样品;
②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硝酸铝广泛用于有机合成、印染工业等。工业上以铝灰为原料(主要成分为Al,含少量Al2O3、Fe2O3、SiO2、CaO、MgO等)制备硝酸铝的工艺流程如下:
已知:Al(OH)3沉淀和溶解的pH如下表:
| Al(OH)3 | 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀溶解完全 |
| pH | 3.3 | 5.0 | 7.8 | 12.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。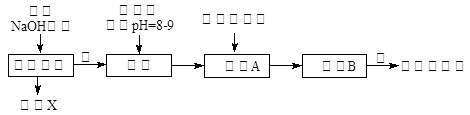
(1)镁铝合金中加NaOH溶液的离子反应方程式为 ,画出金属X的原子结构示意图 ,固体A的化学式为 ;
(2)写出硫酸铝在水中的电离方程式 ,操作②包含的步骤有蒸发浓缩、 、过滤、干燥。
(3)该兴趣小组为测定镁铝合金中各组成的质量分数,设计如图装置,则需要测定的数据有 、 。 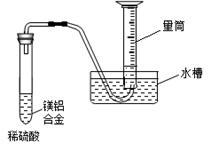
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: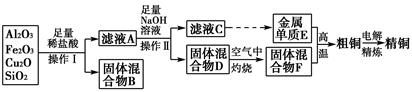
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为____________________________________________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为__________________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→________________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。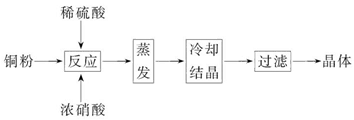
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:_____________、_____________。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是_____________,除去这种杂质的实验操作称为_____________。
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。称取0.100 0 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.100 0 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用
0.100 0 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.100 0 g该试样中含CuSO4·5H2O_____________g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水生成Zn(NH3)22+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表达)。 (2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式____________________________________________。 试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com