
【题目】(12分)二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=-130kJ·mol-1
CH3OH(l)+H2O(l) △H=-130kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH3OH(l)的燃烧热△H=___________。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) △H>0在不同温度下乙酸的生成速率变化如图所示。
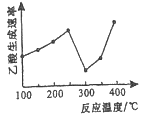
①当温度在250℃—300℃范围时,乙酸的生成速率减慢的主要原因是_________。
②欲使乙酸的平衡产率提高,应采取的措施是_____________(任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。
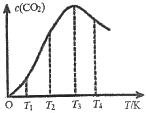
①下列能说明该反应达到平衡的是___________。
A.容器内混合物的质量不变
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
【答案】 728 kJmol-1 催化剂活性降低(或催化剂中毒等) 升高温度或增大压强等 BC 放热 40% 0.02a mol·min-1
【解析】(1)已知:①![]() 130KJ/mol,②2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1。根据盖斯定律,将②
130KJ/mol,②2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1。根据盖斯定律,将②![]() 3/2-①得:
3/2-①得:![]() ,即△H=(-572 kJ·mol -1
,即△H=(-572 kJ·mol -1![]() 3/2)-( -130kJ·mol-1)
3/2)-( -130kJ·mol-1)
=728 kJmol-1故![]() 的燃烧热为728 kJmol-1
的燃烧热为728 kJmol-1
(2)①催化剂的活性与温度有关,当温度在![]() 范围时,乙酸的生成速率减慢的主要原因是催化剂活性较低。答案:催化剂活性降低(或催化剂中毒等)
范围时,乙酸的生成速率减慢的主要原因是催化剂活性较低。答案:催化剂活性降低(或催化剂中毒等)
②欲使乙酸的平衡产率提高,应该使平衡正向移动。因为正反应为吸热反应,升高温度,平衡正向移动,乙酸的平衡产率提高; 增大压强,平衡正向移动,乙酸的平衡产率提高;答案:升高温度或增大压强等
(3)①由2CO(g)![]() C(s)+CO2(g)。是两边气体体积数不等的反应,根据质量守恒定律
C(s)+CO2(g)。是两边气体体积数不等的反应,根据质量守恒定律
A.容器内混合物的质量不变不能作为判断平衡的依据,故A错;B.CO和CO2的物质的量之比不再变化说明CO和CO2的量不在改变,能作为判断平衡的标志;C.混合气体的平均摩尔质量是物质的质量比上物质的摩尔质量,根据方程式混合气体的平均摩尔质量不再变化,可以作为判断平衡的依据; 故C对;D. 根据2CO(g)![]() C(s)+CO2(g)CO CO2分别在等号的两侧,形成amolC=O键的同时形成2amolC
C(s)+CO2(g)CO CO2分别在等号的两侧,形成amolC=O键的同时形成2amolC![]() O键,所以D错;答案为B C。
O键,所以D错;答案为B C。
②向某恒容容器中通入一定量的CO发生上述反应,2CO(g)![]() C(s)+CO2(g),平衡后升高温度,CO2量逐渐减少,说明该反应是放热反应。答案;放热。
C(s)+CO2(g),平衡后升高温度,CO2量逐渐减少,说明该反应是放热反应。答案;放热。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
2CO(g)![]() C(s)+CO2
C(s)+CO2
初始物质的量 a 0 0
变化的物质的量 2x x x
平衡物质的量 a-2x x x
达平衡,CO的体积分数为75%,所以![]() =75% x=0.2a CO的平衡转化率=2
=75% x=0.2a CO的平衡转化率=2![]() 0.2a/a
0.2a/a![]() = 40%。0-10min内平均反应速率v(CO2)=0.2amol/10min = 0.02a mol·min-1.答案:
= 40%。0-10min内平均反应速率v(CO2)=0.2amol/10min = 0.02a mol·min-1.答案:
. 40% 0.02a mol·min-1。


科目:高中化学 来源: 题型:
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl 和MgSO4 及K、Br 等元素)的利用具有非常广阔的前景。
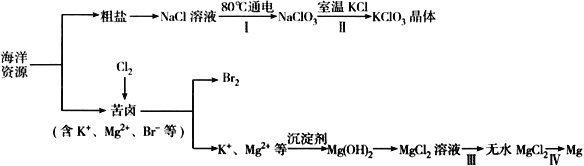
回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Ca2+和Mg2+,要加入的试剂分别为__________________、__________________。
(2)写出步骤Ⅰ 中反应的总化学方程式为NaCl+ ═NaClO3+ 。_____
(3)已知MgCl2 溶液受热时易水解(和水反应)生成Mg(OH)Cl,写出该过程的化学方程式__________________________________。
(4)步骤Ⅳ中,电解熔融MgCl2 得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_______________。
A.N2 B.H2 C.CO2 D.空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于二氧化氮的下列说法中不正确的是( )
A.二氧化氮是一种红棕色气体
B.二氧化氮是造成酸雨的气体之一
C.二氧化氮易溶于水,不能用排水法收集
D.氮气与氧气反应可直接生成二氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是苯和溴的取代反应的实验装置图,其中 A 为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量的铁屑粉。填写下列空白:

(1)向反应容器A 中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A 中发生反应的化学方程式(有机物写结构简式)____;
(2)能证明A 中发生的是取代反应,而不是加成反应,试管C 中苯的作用是__________。反应开始后,观察D 和E 两支试管,看到的现象分别是___________,________;
(3)反应 2 min~3 min 后,在 B 中的氢氧化钠溶液里可观察到的现象是______、_____;
(4)苯是一种重要的化工原料,以下是用苯作为原料制备某些化合物的转化关系图:

已知:a.RNO2 ![]() RNH2
RNH2
b.苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
c.![]() +H2SO4(浓)
+H2SO4(浓)![]()
 +H2O
+H2O
①A 转化为 B 的化学方程式是________;
②E 的结构简式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )

A. 500 mL 2.0 mol·L-1HCl溶液和500 mL 2.0 mol·L-1NaOH溶液的反应符合图(a),且放出热量为ΔE1
B. 500 mL 2.0 mol·L-1H2SO4溶液和500 mL 2.0 mol·L-1Ba(OH)2溶液的反应符合图(b),且吸收热量为ΔE2
C. 发生图(a)能量变化的任何反应,一定不需要加热即可发生
D. CaO、浓硫酸分别溶于水时的能量变化均符合图(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.通常,同周期元素的第一电离能ⅦA族的元素最大
B.主族元素的原子形成单原子离子时的化合价数都和它的族序数相等
C.第ⅠA、ⅡA族元素的原子,其半径越大,第一电离能越大
D.在同一主族中,自上而下第一电离能逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:

(1)图中A、C分别表示______、______,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________________________;
(2)图中△H=__KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H__(要求写计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com