
【题目】铁及其化合物在日常生活中有广泛的应用,回答下列问题。
(1)用K2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是____________(用离子方程式表示);但Fe3+净水要腐蚀设备,在腐蚀钢铁设备时,除H+作用外,另一主要原因是________________________________。
(2)钢铁腐蚀造成很大损失,用如图装置防止钢铁腐蚀(烧杯中均为食盐水),X极的电极材料应是________________(填字母)。
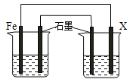
A、锌 B、铜 C、银 D、石墨
(3)高铁电池是一种新型的二次电池,电解液为碱性溶液,其反应式如下:
3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
①写出该电池放电时的正极反应式______________________________。
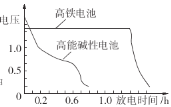
②如图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有______。
(4)从保护环境的角度考虑,制备K2FeO4较好的方法为电解法,其装置如图所示。
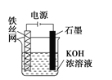
①石墨做电解池的______极(填“阴”或“阳”),溶液中OH-向_____移动(填“铁丝网”或“石墨”)
②电解过程中阳极的电极反应式为______________________________。
③若维持电流强度为6A,电解5小时,理论上可制得K2FeO4的质量为_________g(已知F=96500 C/mol,结果保留1位小数)
(5)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 mol/L 500 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入____mL 2 mol/L的盐酸(滴加盐酸前后,溶液总体积不变)。
【答案】Fe3+ +3H2O![]() Fe(OH)3(胶体)+3H+ 2Fe3+ + Fe = 3Fe2+ A FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH- 使用时间长;工作电压稳定 阴 铁丝网 Fe - 6e- + 8OH- = FeO42- + 4H2O 36.9 g 12.5
Fe(OH)3(胶体)+3H+ 2Fe3+ + Fe = 3Fe2+ A FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH- 使用时间长;工作电压稳定 阴 铁丝网 Fe - 6e- + 8OH- = FeO42- + 4H2O 36.9 g 12.5
【解析】
本题主要考查原电池、电解池的相关知识,由金属的活泼性确定原电池的正负极、电解池的阴阳极,或者由元素的化合价升降确定正负极和阴阳极。
(1)高铁酸钾被还原后的产物Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用,Fe3+水解离子方程式为:Fe3++3H2OFe(OH)3(胶体)+3H+,故答案为Fe3++3H2OFe(OH)3(胶体)+3H+;
铁离子具有氧化性,钢铁设备中的Fe会与铁离子反应生成亚铁离子,离子方程式是:2Fe3++Fe=3Fe2+,故答案为2Fe3++Fe=3Fe2+;
(2)装置为原电池,若用如图装置保护铁,X极的电极材料应比铁活泼,可以选择锌,故答案为A;
(3)①放电时,正极得到电子发生还原反应,FeO42-获得电子生成Fe(OH)3,应有水参与反应,同时生成氢氧根离子,正极电极反应式为:FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-;
故答案为FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-;
②由图可知,高铁电池的优点有放电时间长,工作电压稳定等优点;
故答案为使用时间长;工作电压稳定;
(4)①图为电解池,铁是活泼金属失去电子发生氧化反应,作为电解池的阳极,石墨得到电子发生还原反应,作为阴极,溶液中的阴离子向阳极移动,阳离子向阴极移动,故OH-向阳极即铁丝网移动,故答案为阴;铁丝网;
②K2FeO4能消毒、净水的原因是高价铁具有氧化性,能消毒杀菌,生成Fe3+形成胶体,具有吸附水中悬浮物的净水作用,电解时阳极Fe失去电子发生氧化反应,阳极的电极反应式为Fe - 6e- + 8OH- = FeO42- + 4H2O,故答案为Fe - 6e- + 8OH- = FeO42- + 4H2O;
③维持电流强度为6A,电解5小时,时间为18000s,F=96500 C/mol,Q=It=6C/s×18000s,通过的电子为![]() ,则理论上可制得K2FeO4的最大质量=
,则理论上可制得K2FeO4的最大质量=![]() ≈36.9g,
≈36.9g,
故答案为36.9g;
(5)要使溶液不产生沉淀,则溶液中c(OH-)=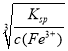 =
=![]() mol/L =2×10-13mol/L,溶液中c(H+)=
mol/L =2×10-13mol/L,溶液中c(H+)=![]() =
=![]() =0.05mol/L,加入稀盐酸体积=
=0.05mol/L,加入稀盐酸体积=![]() =12.5mL;
=12.5mL;
故答案为12.5mL。


科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )

A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硝酸铵的流程如下图所示:
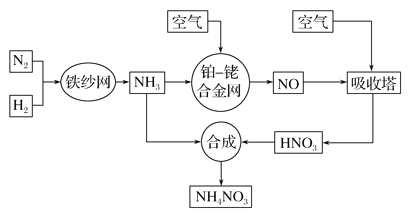
请回答下列问题:
(1)已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ· mol-1。
2NH3(g) ΔH=-92.4 kJ· mol-1。
①在500 ℃、2.02×107 Pa和铁催化条件下向一密闭容器中充入1 mol N2和3 mol H2,充分反应后,放出的热量________(填“大于”、“小于”或“等于”)92.4 kJ。
②为提高H2的转化率,实际生产中宜采取的措施有________(填字母)。
A.降低温度
B.最适合催化剂活性的适当高温
C.适当增大压强
D.减小压强
E.循环利用和不断补充氮气
F.及时移出氨
(2)该流程中铂—铑合金网上的氧化还原反应为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。
4NO(g)+6H2O(g)。
①已知铂—铑合金网未预热也会发热,则随着温度升高,该反应的化学平衡常数K________(填“增大”、“减小”或“不变”),理由是__________________________________________________________________。
②若其他条件不变,则下列图像正确的是________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异秦皮啶具有抗肿瘤功效,秦皮素具有抗痢疾杆菌功效,它们在一定条件下可发生如图所示的转化。下列说法正确的是( )

A.异秦皮啶与秦皮素互为同系物
B.秦皮素一定条件下能发生加成反应、消去反应和取代反应
C.1 mol 秦皮素最多可与 3 mol NaOH 反应
D.每个异秦皮啶分子与氢气完全加成后的产物中含有 5 个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是
A. D元素处于元素周期表中第3周期第ⅥA族
B. 四种元素的原子半径:A<B<C<D
C. B、D的最高价氧化物具有相似的物理性质和化学性质
D. 一定条件下,B单质能置换出D单质,C单质能置换出A单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的盐酸滴定20.00mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸体积关系如右图所示。下列有关叙述错误的是

A. a点溶液呈碱性的原因用离子方程式表示为:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. b点处的溶液中c(Na+)-2c(CO32-)=c(HCO3-)+c(Cl-)
C. 滴定过程中使用酚酞作为指示剂比石蕊更准确
D. d点处溶液中水电离出的c(H+)小于c点处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等有重要意义。
(1)用CO可以合成甲醇,已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;
O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;
CO(g)+![]() O2(g)=CO2(g)△H=-283.0kJmol-1;
O2(g)=CO2(g)△H=-283.0kJmol-1;
H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1;
O2(g)=H2O(l)△H=-285.8kJmol-1;
则CO(g)+2H2(g)![]() CH3OH(g)△H=___________kJmol-1.
CH3OH(g)△H=___________kJmol-1.
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是___________(填写序号).
a.使用催化剂;b.降低反应温度;
c.增大体系压强;d.不断将CH3OH从反应混合物中分离出来;
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醛,平衡转化率与温度、压强的关系如图1所示.
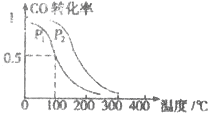
①P1___________P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=___________;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、 H2、CH3OH各0.5amol,则平衡___________(填“向左”“不”或“想右”)移动
(4)利用原电池原理,用SO2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触,请写出该电池的负极的电极反应式___________;
(5)CaSO3溶液与CaC12溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___________。用CaSO3溶液充分吸收SO2得NaHSO2溶液,然后电解该溶液,电解原理示意图如下图所示。请写出该电解池发生反应的化学方程式___________。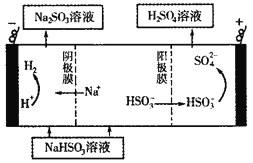
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W为五种原子序数依次增大的短周期元素。已知:
① X元素的原子半径是所有原子中最小的
② Y元素的原子最外层电子数是最内层电子数的2倍
③ Y与R可以形成YR与YR2两种化合物,其中一种是造成温室效应的物质之一
④ W与R能形成原子个数之比为2∶1和1∶1的离子化合物甲和乙。请回答问题:
(1)R在周期表中的位置是____________________
(2)Y、R、W三种元素的原子半径由大到小顺序为____________(用元素符号表示)。
(3)X2R与乙反应的化学方程式是_______________________________________
(4)元素Y、R、W形成的化合物的水溶液常用作清洗厨房的油污,其原理是(用离子方程式表示)____________________________。0.1 mol·L-1的该溶液中,各种阴离子的浓度由大到小关系为________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
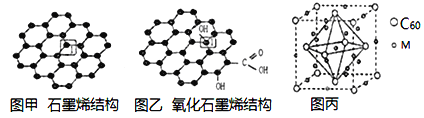
(1)图乙中1号C与相邻C有无形成π键__________(填“有”、或“无”)。
(2)图甲中1号C的杂化方式________。该C与相邻C形成的键角______(填“>”、“<”或“=”)1200。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为______________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________(用含π的代数式表示)。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
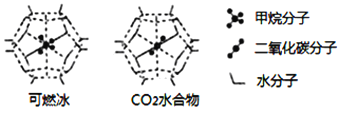
①“可燃冰”中分子间存在的2种作用力是_________;
②有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想能否实现:________ (填“能”、或“否”)。
可燃冰与二氧化碳替换的水合物的熔点较高的是_________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com