
【题目】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
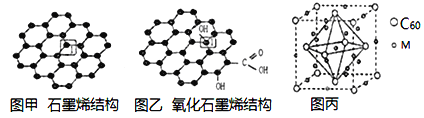
(1)图乙中1号C与相邻C有无形成π键__________(填“有”、或“无”)。
(2)图甲中1号C的杂化方式________。该C与相邻C形成的键角______(填“>”、“<”或“=”)1200。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为______________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________(用含π的代数式表示)。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
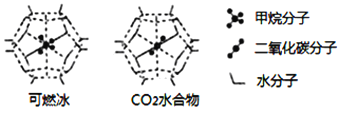
①“可燃冰”中分子间存在的2种作用力是_________;
②有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想能否实现:________ (填“能”、或“否”)。
可燃冰与二氧化碳替换的水合物的熔点较高的是_________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
【答案】无 sp2 = 氧化石墨烯可与水形成氢键更稳定 12 M3C60 ![]() π×100% 氢键、范德华力 能 二氧化碳替换的水合物
π×100% 氢键、范德华力 能 二氧化碳替换的水合物
【解析】
(1)图乙中,1号碳原子形成4个共价单键;
(2)每个C原子要形成4个共价键,根据图知,每个C原子形成2个共价单键、1个共价双键,共价单键为σ键、共价双键中1个是σ键、1个是π键;
(3)氧化石墨烯粒可与水分子形成氢键,稳定性增强;
(4)M原子位于晶胞的棱上与内部,C60分子位于顶点和面心,利用均摊法确定M原子和C60分子的个数比,从而确定化学式;
(5)根据空间占有率=![]() ×100%计算;
×100%计算;
(6)①可燃冰中存在水分子,水分子中存在分子间作用力和氢键;
②依据表格得出二氧化碳的分子直径小于0.586nm,且与水的结合能力为29.91大于16.40。
(1)图乙中,1号碳原子形成4个共价单键,所以其价层电子对个数是4,图乙中1号C与相邻C没有形成π键,故答案为:无;
(2)每个C原子要形成4个共价键,根据图知,每个C原子形成2个共价单键、1个共价双键,共价单键为σ键、共价双键中1个是σ键、1个是π键;图甲中1号C的杂化方式sp2。该C与相邻C形成的键角=1200。故答案为: sp2 ;=;
(3)氧化石墨烯粒可与水分子形成氢键,而石墨烯不能,形成氢键使稳定性增强,
故答案为:氧化石墨烯可与水分子形成分子间氢键而石墨烯不能;
(4)如图M原子位于晶胞的棱上与内部,棱上有12个M,内部有9个M,其个数为12×![]() +9=12,C60分子位于顶点和面心,C60分子的个数为8×
+9=12,C60分子位于顶点和面心,C60分子的个数为8×![]() +6×
+6×![]() =4,M原子和C60分子的个数比为3:1,则该材料的化学式为M3C60,
=4,M原子和C60分子的个数比为3:1,则该材料的化学式为M3C60,
故答案为:12;M3C60
(5)金刚石晶胞如图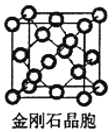 ,该晶胞中C原子个数4+8×
,该晶胞中C原子个数4+8×![]() +6×
+6×![]() =8,金刚石体对角线上的四个原子紧密相连,晶胞棱长a=
=8,金刚石体对角线上的四个原子紧密相连,晶胞棱长a=![]() r,晶胞体积=a3,所有原子体积=
r,晶胞体积=a3,所有原子体积=![]() πr3×8,空间占有率=
πr3×8,空间占有率=![]() ×100%=
×100%= ×100%=
×100%=![]() π×100% ,
π×100% ,
故答案为:![]() π×100% ;
π×100% ;
(6)①CH4与H2O形成的水合物俗称“可燃冰”,分子晶体中作用力是范德华力,水分子之间存在氢键,
故案为:氢键、范德华力;
②由表格可知:二氧化碳的分子直径小于笼状结构的空腔直径,即0.512<0.586,能顺利进入笼状空腔内,且二氧化碳与水的结合能力强于甲烷,即29.91>16.40,二氧化碳替换的水合物的相对分子质量大,熔点较高;
故答案为:能;二氧化碳替换的水合物。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生活中有广泛的应用,回答下列问题。
(1)用K2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是____________(用离子方程式表示);但Fe3+净水要腐蚀设备,在腐蚀钢铁设备时,除H+作用外,另一主要原因是________________________________。
(2)钢铁腐蚀造成很大损失,用如图装置防止钢铁腐蚀(烧杯中均为食盐水),X极的电极材料应是________________(填字母)。
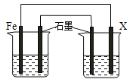
A、锌 B、铜 C、银 D、石墨
(3)高铁电池是一种新型的二次电池,电解液为碱性溶液,其反应式如下:
3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
①写出该电池放电时的正极反应式______________________________。
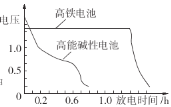
②如图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有______。
(4)从保护环境的角度考虑,制备K2FeO4较好的方法为电解法,其装置如图所示。
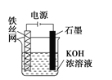
①石墨做电解池的______极(填“阴”或“阳”),溶液中OH-向_____移动(填“铁丝网”或“石墨”)
②电解过程中阳极的电极反应式为______________________________。
③若维持电流强度为6A,电解5小时,理论上可制得K2FeO4的质量为_________g(已知F=96500 C/mol,结果保留1位小数)
(5)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 mol/L 500 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入____mL 2 mol/L的盐酸(滴加盐酸前后,溶液总体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是( )
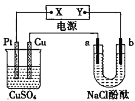
A.X是正极,Y是负极,CuSO4溶液的pH逐渐减小
B..X是正极,Y是负极,CuSO4溶液的pH保持不变
C.X是负极,Y是正极,CuSO4溶液的pH 逐渐减小
D.X是负极,Y是正极,CuSO4溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是![]()
![]()
常见古诗文记载 | 化学知识 | |
A. |
| 黄芽为黄铜 |
B. |
| 强水为氢氟酸 |
C. |
| 利用蒸馏操作 |
D. |
| 利用焰色反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于0.1 mol/L Na2SO3溶液,下列叙述正确的是
A. c(Na+) : c(SO32―) < 2 : 1
B. c(Na+) = 2 c (SO32―) + c(HSO3―) + c(H2SO3)
C. c(Na+) + c(H+) = 2 c (SO32―) + 2 c(HSO3―) + c(OH―)
D. 加入少量NaOH固体,c(SO32―) 与c(Na+) 均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是主要的化工产品。某课题组拟制备乙苯:查阅资料如下:
①几种有机物的沸点如下表:
有机物 | 苯 | 溴乙烷 | 乙苯 |
沸点/℃ | 80 | 38.4 | 136.2 |
②化学原理: ![]() +CH3CH2Br
+CH3CH2Br![]()
![]() +HBr。
+HBr。
③氯化铝易升华、易潮解。
I.制备氯化铝
甲同学选择下列装置制备氯化铝(装置不可重复使用):
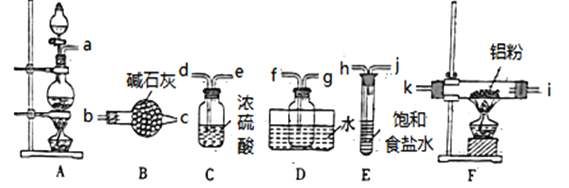
(1)本实验制备氯气的发生装置的玻璃仪器有________种。
(2)连接装置之后,检查装置的气密性,装药品。先点燃A处酒精灯,当___________ 时(填实验现象)点燃F处酒精灯。
(3)气体流动方向是从左至右,装置导管接口连接顺序a→______→k→i→f→g→_____。
(4)D装置存在明显缺陷,若不改进,导致的实验后果是______________。
II.制备乙苯

乙同学设计实验步骤如下:
步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。
步骤2:用酒精灯微热烧瓶。
步骤3:在烧瓶中加入少量无水氯化铝、适量的苯和溴乙烷。
步骤4:加热,充分反应半小时。
步骤5:提纯产品。
回答下列问题:
(5)本实验加热方式宜采用_______ (填“酒精灯直接加热”或“水浴加热”)。
(6)确认本实验A中已发生了反应的试剂可以是___。
A 硝酸银溶液 B 石蕊试液
C 品红溶液 D 氢氧化钠溶液
(7)提纯产品的操作步骤有:
①过滤; ②用稀盐酸洗涤; ③少量蒸馏水水洗 ④加入大量无水氯化钙;⑤用大量水洗; ⑥蒸馏并收集136.2℃馏分 ⑦分液。
操作的先后顺序为⑤⑦__ __⑦__ __⑥(填其它代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于恒温、恒容下的反应 2A(g) + 2B(g)3C(g) + D(g),达到平衡状态的是
A. 单位时间内生成 2n mol A,同时生成 3n mol C
B. 单位时间内生成 n mol B,同时消耗 0.5n mol D
C. 容器内压强不随时间而变化
D. 容器内混合气体的密度不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的容积不变的刚性密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g)+3N(g)![]() xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
A.x值为2
B.反应前与平衡时容器的压强之比为21:25
C.N的转化率为80%
D.混合气体平均摩尔质量不变,不能说明该反应达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电子式书写正确的是( )
①氧原子![]() ②过氧根离子
②过氧根离子![]() ③氢氧根离子
③氢氧根离子![]() ④钠离子[Na]+⑤氢离子H+⑥铵根离子
④钠离子[Na]+⑤氢离子H+⑥铵根离子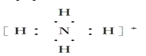 ⑦铝原子
⑦铝原子![]() ⑧溴离子
⑧溴离子![]()
A.①②③⑥⑦B.①③⑥⑦⑧
C.①③⑤⑥⑦⑧D.②③④⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com