
【题目】在一定条件下,在容积为2L的容积不变的刚性密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g)+3N(g)![]() xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
A.x值为2
B.反应前与平衡时容器的压强之比为21:25
C.N的转化率为80%
D.混合气体平均摩尔质量不变,不能说明该反应达平衡
【答案】C
【解析】
平衡时,生成2.4molR,并测得Q的浓度为0.4mol/L,Q物质的量=0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,0.8∶2.4=x∶3,计算得到x=1;
2M(g)+3N(g)Q(g)+3R(g)
起始量(mol) 2 3 0 0
变化量(mol)1.6 2.4 0.82.4
平衡量(mol)0.4 0.6 0.8 2.4
据此分析解答。
A.该反应达平衡时,生成2.4molR,并测得Q的浓度为0.4mol/L,即生成Q为0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,则0.8∶2.4=x∶3,计算得到x=1,故A错误;
B.根据上述分析,反应前后的压强之比=气体物质的量之比=(2+3)∶(0.4+0.6+0.8+2.4)=25∶21,故B错误;
C.根据上述分析,转化的N为2.4mol,则N的转化率为![]() ×100%=80%,故C正确;
×100%=80%,故C正确;
D.混合气体的质量不变,平衡正向移动时物质的量减小,则混合气体平均摩尔质量为变量,因此混合气体平均摩尔质量不变,能够说明该反应达到平衡状态,故D错误;
故选C。


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W为五种原子序数依次增大的短周期元素。已知:
① X元素的原子半径是所有原子中最小的
② Y元素的原子最外层电子数是最内层电子数的2倍
③ Y与R可以形成YR与YR2两种化合物,其中一种是造成温室效应的物质之一
④ W与R能形成原子个数之比为2∶1和1∶1的离子化合物甲和乙。请回答问题:
(1)R在周期表中的位置是____________________
(2)Y、R、W三种元素的原子半径由大到小顺序为____________(用元素符号表示)。
(3)X2R与乙反应的化学方程式是_______________________________________
(4)元素Y、R、W形成的化合物的水溶液常用作清洗厨房的油污,其原理是(用离子方程式表示)____________________________。0.1 mol·L-1的该溶液中,各种阴离子的浓度由大到小关系为________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
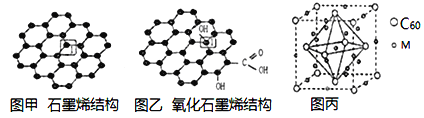
(1)图乙中1号C与相邻C有无形成π键__________(填“有”、或“无”)。
(2)图甲中1号C的杂化方式________。该C与相邻C形成的键角______(填“>”、“<”或“=”)1200。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为______________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________(用含π的代数式表示)。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
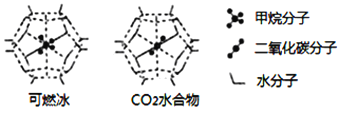
①“可燃冰”中分子间存在的2种作用力是_________;
②有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想能否实现:________ (填“能”、或“否”)。
可燃冰与二氧化碳替换的水合物的熔点较高的是_________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(原创)下列说法不正确的是( )
A.中和热测定实验中,应迅速将NaOH溶液和盐酸在测定装置中混合
B.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
C.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象
D.已知![]() ,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol·L-1KI溶液、0.1 mol·L-1稀硫酸外,还需要用到淀粉溶液
,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol·L-1KI溶液、0.1 mol·L-1稀硫酸外,还需要用到淀粉溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列5种有机物
①![]() ②
②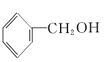 ③
③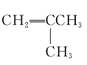 ④
④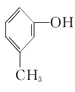 ⑤
⑤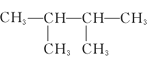
请回答下列问题:
(1)其中互为同系物的是____________和____________,互为同分异构体的是____________和____________(用序号回答)。
(2)用系统命名法给⑤命名,其名称为____________。
(3)有机物②核磁共振氢谱中有____________个峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(![]() )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是
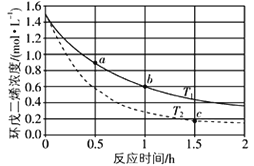
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率小于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应2SO2+O2![]() 2SO3是放热反应,下列说法正确的是( )
2SO3是放热反应,下列说法正确的是( )
A.2 molSO2与1molO2能完全反应生成2 mol SO3,升高温度可以加快此反应的化学反应速率
B.2molSO2与1molO2不能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率
C.2mol SO2与1 molO2能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
D.2molSO2与1molO2不能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1>0,△H3<0
B. △H2>0,△H4>0
C. △H1=△H2+△H3
D. △H3=△H4+△H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com