
【题目】已知可逆反应2SO2+O2![]() 2SO3是放热反应,下列说法正确的是( )
2SO3是放热反应,下列说法正确的是( )
A.2 molSO2与1molO2能完全反应生成2 mol SO3,升高温度可以加快此反应的化学反应速率
B.2molSO2与1molO2不能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率
C.2mol SO2与1 molO2能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
D.2molSO2与1molO2不能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是
A. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键
B. 乳酸有一对对映异构体,因为其分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”解释
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 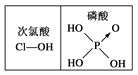
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:A(s)+3B(g)![]() 2C(g) ΔH<0,在体积为10L的密闭容器中发生反应的过程如图所示。下列说法正确的是( )
2C(g) ΔH<0,在体积为10L的密闭容器中发生反应的过程如图所示。下列说法正确的是( )
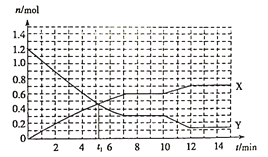
A. X曲线表示B的物质的量随时间变化的关系
B. 第t1 min时说明反应达到了平衡
C. 前4 min,用C表示反应速率为v(C)=0.1 mol·L-1·min-1
D. 第10 min时,可能采取了降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列反应属于丙区域的是( )

A.Cl2+2KBr═Br2+2KClB.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.3Mg+N2![]() Mg3N2D.2Na2O2+2CO2═2Na2CO3+O2
Mg3N2D.2Na2O2+2CO2═2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的铁、铝合金与300mL 2mol/L硝酸完全反应生成3.36LNO(标况)和三价铁盐、铝盐等,再向反应后的溶液中加入3mol/L的NaOH溶液,使铝、铁元素完全沉淀下来,则所加NaOH溶液的体积是( )
A. 450mL B. 150mL C. 200mL D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究 H2O2、 H2SO3、 Br2 氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
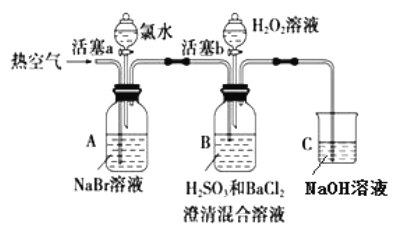
实验记录如下:
实验操作 | 实验现象 | |
① | 打开活塞 a,滴加氯水,关闭活塞 a | _____________________________________________ |
② | 吹入热空气一段时间后停止 | A中溶液颜色明显变浅;B中有气泡,产生大量白色沉淀,沉降后上层清液为无色 |
③ | 打开活塞b,逐滴加入H2O2溶液 | 开始时溶液颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙红色。 |
完成下列填空:
(1)在进行操作①时,A中的实验现象是___________,有关反应的离子方程式是___________。
(2)操作②吹入热空气的目的是____________。B 中产生白色沉淀的化学式是___________。
(3)装置C的作用是____________________。
(4)由上述实验可知,在此实验条件下,H2O2、H2SO3、Br2氧化性强弱顺序为________________。
(5)操作③开始时颜色无明显变化可能原因是(写出一条即可):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名化学家徐光宪获得“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法不正确的是( )
A.铈(Ce)元素在自然界中主要以化合态形式存在
B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.四种稳定的核素![]() Ce、
Ce、![]() Ce、
Ce、![]() Ce、
Ce、![]() Ce,它们互称为同位素
Ce,它们互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为2CH2=CH2+O2===2CH3CHO.下列有关说法不正确的是
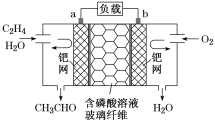
A. 每有0.1molO2反应,则迁移H+0.4mol
B. 负极反应式为CH2=CH2-2e-+H2O=CH3CHO+2H+
C. 电子移动方向:电极a→磷酸溶液→电极b
D. 该电池为不可充电电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com