
【题目】右图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。
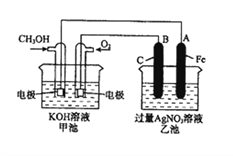
(1)请回答图中甲、乙两池的名称。甲池是________装置,乙池是________装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是__________________,B(石墨)电极的名称是______________________。
(3)写出电极反应式:通入O2的电极的电极反应式是__________________。A(Fe)电极的电极反应式为_______________________________________。
(4)乙池中反应的化学方程式为________________________________________。
(5)当乙池中A(Fe)极的质量增加4.32g时,甲池中理论上消耗O2__________mL(标准状况下)。
【答案】 原电池(化学能转变为电能) 电解池(电能转变为化学能) 负极 阳极 O2+2H2O+4e- =4OH- 4Ag++4e-=4Ag 4AgNO4+2H2O![]() 4Ag+O2↑+4HNO3 224
4Ag+O2↑+4HNO3 224
【解析】(1)从图中可以看出甲池是燃料电池,即化学能转化为电能的装置,因此甲池是原电池,乙池为电解池;
(2)通入甲醇的电极为负极,通入氧气的电极为正极;铁棒与甲醇电极相连,铁被保护,所以A(铁棒)是阴极,B(石墨)是阳极;
(3)通入氧气的电极是正极,在碱性环境下的电极反应为:O2+2H2O+4e- =4OH-;A(Fe)电极为阴极,在硝酸银溶液中该电极的电极反应为4Ag++4e-=4Ag;
(4)乙池是电解池,阳极的电极反应为4OH--4e- =O2↑+2H2O,阴极的电极反应为4Ag++4e-=4Ag,电解硝酸银溶液,电解总反应的化学方程式为4AgNO4+2H2O![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(5)当乙池中A(Fe)极的质量增加4.32 g Ag,生成银的物质的量为0.04 mol,转移电子的物质的量为0.04 mol,根据电子守恒,消耗O2的物质的量为0.01 mol,在标况下,消耗O2的体积为0.224 L,即224 mL。


科目:高中化学 来源: 题型:
【题目】已知:4HCl(g)+O2(g)2Cl2(g)+ 2H2O(g),该反应放出123kJ/mol的热量。其中相关的化学键键能数据如下:其中a的值为
化学键 | H—Cl | O=O | Cl—Cl | H—O |
E/(kJ/mol) | 431 | 497 | a | 465 |
A.242B.303.5C.180.5D.365
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F有以下转化关系。A的产量可以衡量一个国家的石油化工发展水平;E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F为高分子化合物。结合下图关系回答问题:
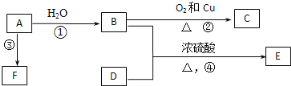
(1)写出C的结构简式:___________。
(2)写出B、D中官能团的名称:B____________,D_____________。
(3)写出下列反应的化学方程式:
②_________________________。
④________________________。
(4)物质B可以直接被氧化为D,需加入的试剂是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.若反应X+Y=M是放热反应,该反应一定不用加热
B.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
C.化学反应伴随的能量有热能和电能二种
D.热值指一定条件下,每1mol的物质完全燃烧所放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年12月,华为宣布: 利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是
C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是

A. 该电池若用隔膜可选用质子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 充电时,LiCoO2极 发生的电极反应为: LiCoO2-xe-=Li1-xCoO2+xLi+
D. 废旧的该电池进行“放电处理”让Li+从石墨烯中脱出而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有SO42-、CO32-、Cl-三种阴离子。
如果每次只检验一种离子,完成下面的填空。
(1)先检验CO32-,加入________试剂(或溶液),反应的离子方程式为_____。
(2)然后检验SO42-,加入________试剂(或溶液),反应的离子方程式为___。
(3)最后检验Cl-,加入________试剂(或溶液),反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. ![]() 先增大再减小
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化镁(MgBr2)可由金属镁在室温下与干燥后的溴在乙醚中反应制得,利用如图所示装置制备溴化镁,并测定其产率。已知:
①Mg和Br2反应剧烈且放热,MgBr,2具有强吸水性;
②MgBr2+3C2H5OC2H5=MgBr2·3C2H5OC2H5.
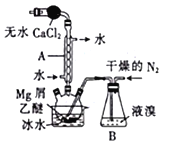
(1)保存液溴时在瓶内加入适量的蒸馏水,其目的是___________。
(2)球形干燥管中放入无水CaCl2的作用是______________,仪器A的名称是________。
(3)实验时,应缓慢通入干燥的氮气,直至溴完全导入三颈烧瓶中。如果将所用液溴一次性全部加入三颈烧瓶中,其后果是___________________。
(4)反应完毕后恢复至室温过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得到三乙醚合溴化镁(MgBr2·3C2H5OC2H5)粗品。第一次过滤得到的固体物质是_______。
(5)常温下用苯溶解粗品,冷却至0℃,析出晶体,经操作a得到三乙醚合溴化镁,加热至160℃分解得到无水MgBr2产品。
①操作a是________________。
②写出三乙醚合溴化镁加热至160℃分解得无水MgBr2的化学方程式:_______________。
(6)反应开始前装入5.0g镁屑和150mL无水乙醚,无水MgBr2在干燥器中冷却到室温后,称量,其质量为29.8g。则该实验制取MgBr2的产率是__________(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com