
【题目】对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解释,说法正确的是
A. Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化
B. Mg(OH)2比MgCO3更难溶,且在水中发生了沉淀转化
C. MgCO3电离出的CO![]() 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
D. 二者不能相互转化
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.001mol·L-1·s-1
B. 将容器体积变为20L,Z的平衡浓度变为原来的![]()
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH 溶液中有1% CH3COOH 分子发生电离,则溶液的pH=______________;可以使0.10mol·L-1 CH3COOH的电离程度增大的是____________。、
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1. d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH 均等于3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液有锌粉剩余,则生成氢气的体积:V( 盐酸)________V(醋酸)(填“>”、“ <” 或“=”)。
(3)0.1mol/L 的某酸H2A 的pH=4,则H2A 的电离方程式为_________________。
(4)某温度下,Kw=1×10-12,将0.02mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混和液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室制取氨气的化学方程式_________。检验氨气已装满的方法是________。
(2)氨气可用如图装置进行喷泉实验,把氨气换成______(填序号)也可形成喷泉实验。
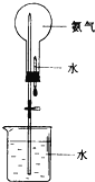
A.二氧化碳 B.氧气 C.氯化氢气体 D.氢气
(3)完成氨催化氧化生成为NO的反应方程式,4NH3+____O2===4NO+6_____,产物NO能在通常状况下被空气氧化为NO2,请完成下列反应生成硝酸的化学方程式:4NO+__O2+2H2O===4HNO3,___NO2+____O2 +__H2O===4HNO3
(4)12.8 g Cu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F有以下转化关系。A的产量可以衡量一个国家的石油化工发展水平;E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F为高分子化合物。结合下图关系回答问题:
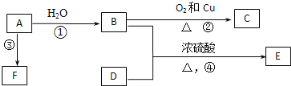
(1)写出C的结构简式:___________。
(2)写出B、D中官能团的名称:B____________,D_____________。
(3)写出下列反应的化学方程式:
②_________________________。
④________________________。
(4)物质B可以直接被氧化为D,需加入的试剂是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁黄是一种重要的颜料,化学式为Fe2O3xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等) 和黄铁矿粉(主要成分为FeS2) 制备铁黄的流程如下。
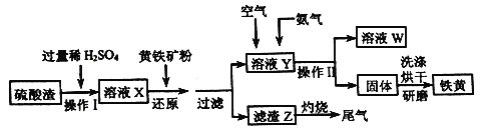
回答下列问题:
(1)操作I中为了提高硫酸渣的溶解速率,可采取的措施有_________(答两条即可)。
(2)溶液X中含有的金属离子有Fe3+和_____;溶液X中加入黄铁矿粉后,先发生反应FeS2+H2SO4( 稀)=FeSO4+ H2S↑+S↓,H2S 再将Fe3+还原,其离子方程式为_________。
(3)在溶液Y 中通入空气的目的是______________,再通入NH3后可观察到的现象是__________,若通入NH3后溶液的pH 过高,会影响产品纯度,原因是_________。
(4)操作II中除用到玻璃棒外,还需要的玻璃仪器是________。
(5)若将滤渣Z灼烧产生的尾气通入溶液X 中,充分反应后溶液的pH____(填“增大”、“减小”或“不变”)。
(6)为了测定所制备铁黄Fe2O3xH2O中x的值,用分析天平准确称量m1g样品置于坩埚中加热、冷却后称量;经过重复操作,当达到恒重时,残留固体质量为m2g,则x =______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年12月,华为宣布: 利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是
C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是

A. 该电池若用隔膜可选用质子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 充电时,LiCoO2极 发生的电极反应为: LiCoO2-xe-=Li1-xCoO2+xLi+
D. 废旧的该电池进行“放电处理”让Li+从石墨烯中脱出而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香蕉果实成熟过程中由于储存的物质变为可溶性糖从而使果实甜度增加。某兴趣小组对此生理变化进行了初步探究:取未成熟香蕉果实若干放在适宜条件下让其自然成熟,每天定时取10 g果肉研磨配制成100 mL待测样液平分为A、B两份,分别用碘液和斐林试剂检测,记录颜色深浅的变化。
(1)样液A用碘液检测的目的是__________________;样液B用斐林试剂检测的目的是___________。
(2)斐林试剂使用时需甲、乙液等量混合均匀后再注入,并____________观察颜色变化。
(3)根据预期结果在坐标图中画出两种颜色的变化。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com