
【题目】对于合成氨N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
A. 升高温度,对正反应的反应速率影响更大
B. 增大压强,对正反应的反应速率影响更大
C. 减小反应物浓度,对逆反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe2+、Al3+、NH4+、Cl、CO32 和SO42。现每次取100.00mL进行实验:(已知:NH4++OH - ![]() NH3↑ +H2O)
NH3↑ +H2O)
① 第一份加入AgNO3溶液有沉淀产生;
② 第二份加入足量NaOH后加热,收集到气体0.896 L(标准状况下)
③ 第三份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。请回答:
(1)c(CO32) =_________mol/L;
(2)K+ 是否存在?__________;若存在,浓度范围是__________(若不存在,则不必回答第2问);
(3)根据以上实验,不能判断______(填离子符号)是否存在。若存在此离子,如何进行检验?_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氰基丙烯酸酯是一种用途广泛且具有粘性的材料,其合成原理如图:

已知:RCN在一定条件下,发生水解反应,其产物为RCOOH和NH3。
下列说法正确的是
A.M能使酸性高锰酸钾溶液褪色,不能使溴水褪色
B.上述反应类型是缩聚反应
C.1molM的水解产物最多消耗1molNaOH
D.若R为甲基,N的平均相对分子质量为11100,则n=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M被广泛用于医药、香料的合成,其一种合成路线如下(反应试剂与反应条件已省略)
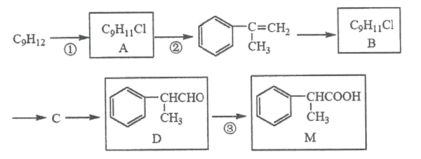
已知A与B互为同分异构体。
(1)1molD最多能与______molH2发生加成反应。
(2)反应①所需的试剂和条件是____________,反应③的反应类型是____________。
(3)反应②的化学方程式是____________。
(4)写出检验D已经完全转化为M的方法____________。
(5)写出一种符合下列要求的M的同分异构体的结构简式____________。
i. 苯环上的一氯代物只有两种 ii. 能发生水解反应 iii. 分子中含有两个甲基
(6)写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图。
的合成路线流程图。
已知:![]()
___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是 ( )
A. 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
B. 金刚石为空间网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
C. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
D. 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
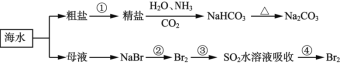
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.侯氏制碱应先通NH3再通CO2
C.在第②、③、④步骤中,溴元素均被氧化
D.③④的目的是进行溴的富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是从NaCl和CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
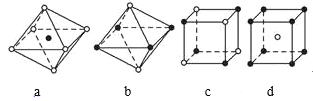
A.只有cB.b和cC.a和cD.a和d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为原子序数依次增大的四种短周期主族元素,前三种元素原子的电子层数相同,Y、W元素原子的最外层电子数相同。表给出了四种元素的部分信息,则下列说法正确的是
元素 | X | Y | Z | W |
原子半径/nm | 0.134 | r1 | r2 | 0.106 |
A.r1>r2>0.106
B.0.134<r1<r2
C.0.134>r1>r2
D.电子层数多的元素的原子半径一定比较大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池与电解池在生活和生产中有着广泛应用。下列有关判断中正确的是
A.装置甲研究的是电解CuCl2溶液,阳极发生的反应:2Cl-+2e-===Cl2↑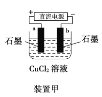
B.装置乙研究的是金属的吸氧腐蚀,Fe上的反应为Fe-3e-===Fe3+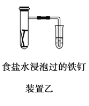
C.装置丙研究的是电解饱和食盐水,B电极发生的反应:2H2O+2e-===H2↑+2OH-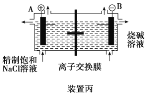
D.向装置丁烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成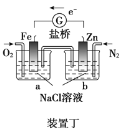
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com