
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJmol-1,
C(s)+CO2(g)═2CO(g)△H2=+172.5kJmol-1
则CO还原Fe2O3(s)的热化学方程式为__________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图1。
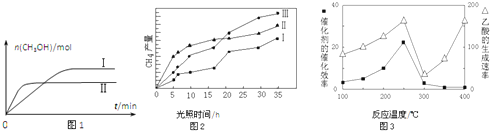
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ__________KⅡ(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为__________。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化见图2.在0~15小时内,CH4的平均生成速率I、II和III从大到小的顺序为__________(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:__________。
【答案】(1)Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
(2)CO+4OH--2e-=CO32-+2H2O;(3)①>;②0.4<n(c)≤1mol,
(4)Ⅱ>Ⅲ>I;(5)①300℃~400℃;②3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O。
【解析】试题分析:(1)①Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJmol-1②C(s)+CO2(g)═2CO(g) △H2=+172.5kJmol-1,由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=-28.5kJmol-1,故答案为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
(2)烷燃料电池以KOH溶液为电解质溶液时,负极上是CO发生失电子的氧化反应,又因为电解质是KOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即CO+4OH--2e-=CO32-+2H2O,故答案为:CO+4OH--2e-=CO32-+2H2O;
(3)①II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,即II的温度大于I,温度越高,平衡向逆反应方向移动,导致化学平衡常数越小,所以KⅠ>KⅡ,故答案为:>;
②设二氧化碳反应量为x
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始量(mol): 1 3 0 0
转化量(mol): x 3x x x
平衡量(mol): 1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即![]() =0.8
=0.8
解得x=0.4mol
依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<n(c)≤1mol,
故答案为:0.4<n(c)≤1mol;
(4)由图2可知,在0~15h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅲ)<△n(Ⅱ),故在0~15h内,CH4的平均生成速率v(Ⅱ)>v(Ⅲ)>v(Ⅰ),故答案为:Ⅱ>Ⅲ>I;
(5)①温度超过250℃时,催化剂的催化效率降低,在300℃时失去活性,故以后乙酸的生成速率升高是由温度升高导致的,故乙酸主要取决于温度影响的范围为300℃~400℃,故答案为:300℃~400℃;
②Cu2Al2O4拆成氧化物的形式:Cu2OAl2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O。


科目:高中化学 来源: 题型:
【题目】香料甲和G在生活中有很多用途,工业上利用有机物A(![]() )来制备,其合成路线如下:
)来制备,其合成路线如下:

已知:R1—CHO+R2—CH2—CHO ![]()
![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
回答下列问题:
(1)C的名称是____,G中官能团的名称是__________。
(2)②的反应类型是________,F的结构简式为_______________。
(3)下列关于C的叙述正确的是___________.
A. 分子式为C9H10O B. 1mol E最多能与5molH2发生加成反应
C. 自身能发生加聚、缩聚反应 D. 最多有9个碳原子位于同一平面
(4)C有多种同分异构体,其中属于芳香族化合物的有____种。
(5)写出反应①的化学方程式__________________________________。
(6)F的同分异构体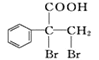 是一种重要的药物中间体,其合成路线与G相似,请以为原料设计它的合成路线(其他所需原料自选)。____________
是一种重要的药物中间体,其合成路线与G相似,请以为原料设计它的合成路线(其他所需原料自选)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1 mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则()
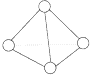
A. N4的熔点比P4高
B. 1 mol N4气体转化为N2时要吸收724 kJ能量
C. N4是N2的同系物
D. 1 mol N4气体转化为N2时要放出724 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠投入到滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生
③反应后溶液变红
④钠熔成闪亮的小球
⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作为负极,③④中Fe作为负极
B. ②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某品牌饮用矿物质水标签的部分内容。下列说法正确的是

A. 标签上给出的离子的物理量是物质的量浓度
B. 任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L之间
C. 该品牌饮用矿物质水中c(Mg2+)的最大值为2×10-4 mol/L
D. 一瓶该品牌饮用矿物质水中SO42-的物质的量不超过1×10-5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com