
【题目】在体积为VL的密闭容器中存在化学平衡:2NO2(g)![]() N2O4(g),ΔH<0。保持温度不变,将容器体积增大至2V后,下列说法不正确的是( )
N2O4(g),ΔH<0。保持温度不变,将容器体积增大至2V后,下列说法不正确的是( )
A.容器内气体颜色变深B.容器内N2O4分子数减小
C.混合气体的平均相对分子质量增大D.NO2的物质的量分数增大
【答案】AC
【解析】
反应2NO2(g)![]() N2O4(g),ΔH<0为放热反应,正向体积缩小,保持温度不变,将容器体积增大至2V后相当于减小压强,根据勒夏特列原理进行分析。
N2O4(g),ΔH<0为放热反应,正向体积缩小,保持温度不变,将容器体积增大至2V后相当于减小压强,根据勒夏特列原理进行分析。
A. 减小压强,各物质的浓度降低,容器内气体的颜色逐渐变浅,A项错误;
B. 减小压强,平衡向体积增大的方向移动,即平衡逆向移动,容器内N2O4分子数逐渐减小,B项正确;
C. 由质量守恒有平衡后物质的总质量不变,减小压强,平衡向体积增大的方向移动,即平衡逆向移动,气体的物质的量逐渐增大,混合气体的平均相对分子质量减小,C项错误;
D. 减小压强,平衡向体积增大的方向移动,即平衡逆向移动,NO2的物质的量逐渐增多,物质的量分数逐渐增大,D项正确;
答案选AC。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
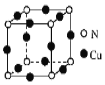
【题目】室温下,[Cu(NH3) 4]( NO3) 2与液氨混合并加入Cu可制得一种黑绿色晶体。
(1)基态Cu2+核外电子排布式是______。
(2)黑绿色晶体的晶胞如图所示,写出该晶体的化学式:______。
(3)[Cu(NH3)4]2+中配位体的空间结构结构为______
(4)![]() 中N原子轨道的杂化类型是______。与
中N原子轨道的杂化类型是______。与![]() 互为等电子体的一种分子为______(填化学式)。
互为等电子体的一种分子为______(填化学式)。
(5)氨极易溶于水的原因是______。
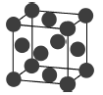
(6)金属铜的堆积方式如图所示:若该晶胞参数a=658pm,则该晶胞密度为________(列出计算表达式)g·cm-3。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀。用电离平衡原理解释上述现象。_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:
NO(g)+CO(g)![]()
![]() N2(g)+CO2 (g) ΔH=-373.4 kJ·mol-1
N2(g)+CO2 (g) ΔH=-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
A.  B.
B. 
C.  D.
D. 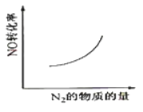
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度恒定的条件下,在2L容积不变的密闭容器中,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。开始充入4mol的SO2和2mol的O2,10s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是( )
2SO3(g)。开始充入4mol的SO2和2mol的O2,10s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是( )
A.v(SO2)∶v(O2)=2∶1B.10s内,v(SO3)=0.05mol·L-1·s-1
C.SO2的平衡转化率为25%D.平衡时剩余SO2的物质的量为3.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铈铵、磷酸锰铵是两种重要的复盐,在工农业生产中具有广泛应用。
(1) 复盐是由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐。下列物质属于复盐的是________(填序号)。
A.BaFe2O4 B.NaHSO4 C.KAl(SO4)2·12H2O D.Ag (NH3)2OH
(2) 硝酸铈铵[(NH4)2Ce(NO3)6]的制备方法如下:

①“氧化”得到CeO2的化学方程式为________________________________。
②证明CeO2已经洗涤干净的方法是_____________________________。
(3) 为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:①称取样品2.448 0 g,加水溶解后配成100.00 mL溶液A;②量取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 0.067 20 L(标准状况);③另取25.00 mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH 6 ~ 8,充分反应后,将溶液中Mn2+转化为Mn3O4,得Mn3O4 0.2290 g。通过计算确定该样品的化学式(写出计算过程) __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2A(s)+B(g) ![]() 2C(g)+D(g),经2minB的浓度减少0.6mol/L。下列有关说法正确的是( )
2C(g)+D(g),经2minB的浓度减少0.6mol/L。下列有关说法正确的是( )
A.用A表示的反应速率是![]()
B.分别用B、C、D表示反应的速率,其比是1∶2∶1
C.2min末时的反应速率用反应物B来表示的是![]()
D.在2min内用B和C表示的反应速率的值是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国研制成功的全球唯一的治疗疟疾特效药——青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示。目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求。下列关于青蒿素的说法正确的是( )
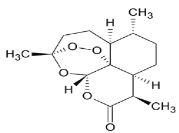
A.是一种烃
B.属于高分子化合物
C.属于芳香族化合物
D.分子式是C15H22O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如图1所示。
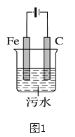
回答下列问题:
(1)电解过程中,电解池阴极的电极反应式为______;控制电流,可使电解池阳极同时发生两个电极反应:其中一个为2H2O -4e- === O2↑+ 4H+,另一个电极反应式为______。
(2)电解池溶液中得到Fe(OH)3沉淀的离子方程式为______。
(3)某熔融盐燃料电池以熔融的多种碱金属碳酸盐混合物为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极,如图2。若该熔融盐燃料电池为电浮选凝聚法的电解电源,则:
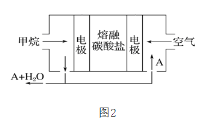
①正极的电极反应式为______;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是______。
③实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池理论上消耗CH4______L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com