
【题目】温度恒定的条件下,在2L容积不变的密闭容器中,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。开始充入4mol的SO2和2mol的O2,10s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是( )
2SO3(g)。开始充入4mol的SO2和2mol的O2,10s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是( )
A.v(SO2)∶v(O2)=2∶1B.10s内,v(SO3)=0.05mol·L-1·s-1
C.SO2的平衡转化率为25%D.平衡时剩余SO2的物质的量为3.5mol
【答案】D
【解析】
根据方程式利用三段法进行计算并判断。
平衡时n(SO3)= 0.5 mol·L-1×2L=1mol
2SO2(g) + O2(g) ![]() 2SO3(g)
2SO3(g)
始(mol) 4 2 0
转(mol) 1 0.5 1
平(mol) 3 1.5 1
A. 由以上分析可知v(SO2)=![]() =0.05mol·L-1·s-1,v(O2)=
=0.05mol·L-1·s-1,v(O2)=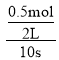 =0.025mol·L-1·s-1,则v(SO2)∶v(O2)=0.05:0.025=2∶1,A项正确;
=0.025mol·L-1·s-1,则v(SO2)∶v(O2)=0.05:0.025=2∶1,A项正确;
B. v(SO3)=![]() =0.05mol·L-1·s-1,B项正确;
=0.05mol·L-1·s-1,B项正确;
C. SO2的平衡转化率=![]() ×100%=25%,C项正确;
×100%=25%,C项正确;
D.由以上分析知平衡时剩余SO2的物质的量为3mol,D项错误;
答案选D。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构∧,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的一氯代物只有4种
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的分子式为C8H18
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
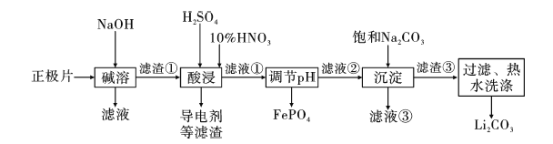
已知:KSP ( Li2CO3)=2.0×10-3 。部分物质的溶解度(S)如下表所示:
T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | —— |
100 | 0.72 | —— |
(1) 流程中用“热水洗涤”的原因是____________。
(2)写出碱溶时Al箔溶解的化学方程式 ___________。
(3)酸浸时,用H2O2代替HNO3更好,其优点是________。
(4)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为____。
(5)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3溶液后,Li+的沉降率达到90%,计算滤液③中c(CO32-)=____mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘与氢气在一定条件下反应的热化学方程式如下:
(Ⅰ)I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(Ⅱ)I2(s)+H2(g)![]() 2HI(g) ΔH=+26.48 kJ·mol-1
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A. 在一定条件下将2 g H2(g)通入254 g I2(g)中,该过程放出的热量为9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D. 物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的密闭容器中存在化学平衡:2NO2(g)![]() N2O4(g),ΔH<0。保持温度不变,将容器体积增大至2V后,下列说法不正确的是( )
N2O4(g),ΔH<0。保持温度不变,将容器体积增大至2V后,下列说法不正确的是( )
A.容器内气体颜色变深B.容器内N2O4分子数减小
C.混合气体的平均相对分子质量增大D.NO2的物质的量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B![]() C(ΔH < 0)分两步进行:①A+B
C(ΔH < 0)分两步进行:①A+B![]() X(ΔH>0); ②X
X(ΔH>0); ②X![]() C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )。
C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )。
A.
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4是一种黑色粉末,又称磁性氧化铁,它的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
Ⅰ.提出假设: 假设1.黑色粉末是CuO;假设2.黑色粉末是Fe3O4;
假设3.黑色粉未是CuO和Fe3O4的混合物
Ⅱ.设计探究实验:
方案一:取少量粉末加入足量稀硝酸,若假设2或假设3成立则实验现象是___________,相关反应的离子方程式为__________________________________。
方案二: 查阅资料: Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若产生___________现象,则假设2成立;若产生___________现象,则假设3成立。
方案三:
学生丙利用下图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
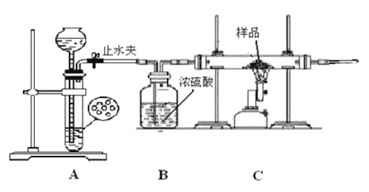
(1)下列实验步骤的先后顺序是___________(填序号)。
①打开止水夹;②关闭止水夹;③点燃C处的酒精喷灯;
④熄灭C处的酒精喷灯 ⑤收集氢气并验纯。
在点燃C处酒精喷灯前要进行的必要操作是__________________________。
(2)假设样品全部参加反应,若实验前样品的质量为4.7克,实验后称得装置C中固体的质量3.6克则假设___________(填“1”“2”或“3”) 正确。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com