
【题目】某小组同学欲通过实验验证氯元素的非金属性强于硫元素。
(1)他们将过量硫粉与少量铁粉混合后隔绝空气加热,制得并分离出固体产物A。请帮他们完成实验报告。
实验步骤和操作 | 实验现象 | 实验结论或解释 |
①取少量A于试管中,加入足量稀硫酸 | 固体完全溶解,产生有臭鸡蛋气味的气体B | 硫粉与铁粉混合后隔绝空气加热,制得固体产物A是__________(填化学式) |
②将B通入足量水中 | 得到无色溶液C | |
③向①的试管中加入KSCN溶液 | 溶液无明显变化 | |
④将浓盐酸滴到KMnO4固体上 | 产生黄绿色气体 | 反应生成氯气 |
⑤将红热的铁丝(少量)伸入上述黄绿色气体中 | 铁丝剧烈燃烧,产生大量棕黄色的烟 | 反应的化学方程式为__________ |
⑥将⑤中所得固体产物溶于水,在所得溶液中滴加KSCN溶液 | 观察到___________(填现象) |
(2)综合上述实验现象和结论,___________(填“能”或“不能”)验证氯元素的非金属性强于硫元素,理由是_____________________________________。
(3)某同学将上述实验中④所得氯气直接通入无色溶液C中,观察到产生淡黄色固体,反应的化学方程式为_______________,此实验______________(填“能”或“不能”)验证氯元素的非金属性强于硫元素。
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,则可以说明氯元素的非金属性强于硫元素,他的观点____________(填“正确”或“错误”),原因是_____________。
(5)现有四种试剂:A.新制的Cu(OH)2;B.浓硝酸;C.AgNO3溶液;D.碘水。为了鉴别下列三瓶无色溶液,请你选择合适的试剂,将其序号填入相应的括号中。(每个小题只有一个正确答案):
①葡萄糖溶液_____________②淀粉溶液_____________③鸡蛋清溶液____________。
【答案】FeS 2Fe + 3Cl2![]() 2FeCl3 溶液变成红色 能 铁与硫反应生成亚铁离子,而铁与氯气反应生成铁离子,氯气的氧化性强于硫的氧化性,说明氯元素的非金属性强于硫元素 Cl2+H2S=2HCl+S↓ 能 错误 HCl和H2S不是Cl和S元素的最高价氧化物的水化物 A D B
2FeCl3 溶液变成红色 能 铁与硫反应生成亚铁离子,而铁与氯气反应生成铁离子,氯气的氧化性强于硫的氧化性,说明氯元素的非金属性强于硫元素 Cl2+H2S=2HCl+S↓ 能 错误 HCl和H2S不是Cl和S元素的最高价氧化物的水化物 A D B
【解析】
(1)①取少量A于试管中,加入足量稀硫酸,固体完全溶解,产生有臭鸡蛋气味的气体B,B为H2S;②C为H2S的水溶液;③向①的试管中加入KSCN溶液,溶液无明显变化,说明溶液①中没有铁离子,据此分析判断A的组成;⑤将红热的铁丝(少量)伸入上述黄绿色气体(氯气)中,铁丝剧烈燃烧,产生大量棕黄色的烟,溶于水,在所得溶液中滴加KSCN溶液,溶液变成红色,说明生成了氯化铁,据此分析解答;
(2)根据铁与硫,铁与氯气反应的产物中铁的化合价分析判断并解答;
(3)氯气直接通入H2S溶液中,观察到产生淡黄色固体,根据反应的化学方程式结合元素非金属性的判断方法分析判断;
(4)将步骤①中的稀硫酸换成稀盐酸,发生的反应为2HCl+FeS=H2S+FeCl2,根据非金属性的判断方法分析判断;
(5)鸡蛋清溶液的主要成分为蛋白质,根据葡萄糖、淀粉、蛋白质的特征反应分析解答。
(1)①取少量A于试管中,加入足量稀硫酸,固体完全溶解,产生有臭鸡蛋气味的气体B,B为H2S;②C为H2S的水溶液;③向①的试管中加入KSCN溶液,溶液无明显变化,说明溶液①中没有铁离子,因此A为FeS;⑤将红热的铁丝(少量)伸入上述黄绿色气体(氯气)中,铁丝剧烈燃烧,产生大量棕黄色的烟,生成了氯化铁,反应的化学方程式为2Fe + 3Cl2![]() 2FeCl3;⑥将⑤中所得固体产物(氯化铁)溶于水,在所得溶液中滴加KSCN溶液,溶液变成红色,故答案为:FeS;2Fe + 3Cl2
2FeCl3;⑥将⑤中所得固体产物(氯化铁)溶于水,在所得溶液中滴加KSCN溶液,溶液变成红色,故答案为:FeS;2Fe + 3Cl2![]() 2FeCl3;溶液变成红色;
2FeCl3;溶液变成红色;
(2)根据上述实验现象和结论,铁与硫反应生成亚铁离子,而铁与氯气反应生成铁离子,说明氯气的氧化性强于硫,因此氯元素的非金属性强于硫元素,故答案为:能;铁与硫反应生成亚铁离子,而铁与氯气反应生成铁离子,氯气的氧化性强于硫的氧化性,说明氯元素的非金属性强于硫元素;
(3)某同学将上述实验中④所得氯气直接通入无色溶液C(H2S溶液)中,观察到产生淡黄色固体,反应的化学方程式为Cl2+H2S=2HCl+S↓,氯气的氧化性强于硫的氧化性,说明氯元素的非金属性强于硫元素,故答案为:Cl2+H2S=2HCl+S↓;能;
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,发生的反应为2HCl+FeS=H2S+FeCl2,HCl和H2S都不是最高价含氧酸,不能说明氯元素的非金属性强于硫元素,故答案为:错误;HCl和H2S不是Cl和S元素的最高价氧化物的水化物;
(5)①葡萄糖溶液能够与新制的Cu(OH)2反应生成砖红色沉淀,可以用新制的Cu(OH)2鉴别葡萄糖,故答案为:A;
②淀粉溶液遇到碘水变蓝色,可以用碘水鉴别淀粉溶液,故答案为:D;
③浓硝酸能够使鸡蛋清溶液变黄色,可以用浓硝酸鉴别鸡蛋清溶液,故答案为:B。


科目:高中化学 来源: 题型:
【题目】在一定条件下,将![]() 和
和![]() 置于一容积为2L的密闭容器中发生反应:
置于一容积为2L的密闭容器中发生反应:![]() ,反应过程中
,反应过程中![]() 、
、![]() 和
和![]() 的物质的量变化如下图:
的物质的量变化如下图:

(1)该反应化学平衡常数K的表达式为________。随着温度升高,平衡常数________(选填“增大”、“减小”或“不变”)。计算![]() 的平均反应速率
的平均反应速率![]() ________。
________。
(2)下列说法不能表明该反应达到平衡状态的是________。
a.容器内的压强不再变化 b.容器内气体的密度不再变化
c.![]() d.3mol H-H键断裂的同时,有6mol N-H键生成
d.3mol H-H键断裂的同时,有6mol N-H键生成
(3)0-10min、10-20min两个时间段内,![]() 的平均反应速率之比为________。在第10min可能改变的条件是__________________________________________。
的平均反应速率之比为________。在第10min可能改变的条件是__________________________________________。
(4)反应进行至25min时,曲线发生变化的原因是__________________________________________________.为使反应速率减小,且平衡向正反应方向移动,可采取的措施是________。
a.增大容器的体积 b.降低温度 c.使用催化剂
(5)在图中画出25min-40min时间段内![]() 的物质的量的变化图像(画在上图中)。__________________
的物质的量的变化图像(画在上图中)。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是

A. W点所示的溶液中:c(Na+)>c(CO32-)= c(HCO3-)>c(OH-)>c(H+)
B. pH=4的溶液中:c(H2CO3)+c(HCO3-)+ c(CO32-)=0.1mol/L
C. pH=8的溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. pH=11的溶液中:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确表示下列反应的离子反应方程式为
A.向FeBr2溶液中通入足量氯气:2Fe2++4Br﹣+3Cl2═2 Fe3++2 Br2+6Cl﹣
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:![]()
C.![]() 稀溶液与过量的KOH溶液反应:
稀溶液与过量的KOH溶液反应:![]()
D.醋酸除去水垢:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了a~m 13种元素在周期表(已省略了过渡元素)中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | a | |
2 | b | c | d | |||||
3 | e | f | g | h | i | |||
4 | j | k | l | |||||
5 | m |
(1)元素b为________(填名称);画出g的原子结构示意图__________。
(2)元素f、i、j的原子半径从大到小的顺序是____________(用元素符号表示);这三种原子分别形成简单离子后,离子半径从大到小的顺序是_____________(用离子符号表示)。
(3)h和k的原子序数相差___________(填数字)。
(4)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为___________,该化合物中化学键有____________,该化合物与c的最高价氧化物反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图各物质中,A、B、C是常见金属单质,甲、乙、丙是气体且乙是黄绿色的气体(图中有些反应的产物和反应的条件没有全部标出)。

写出有关反应的离子方程式:
反应①_____。
反应②_____。
反应③_____。
(2)沉Co是用碳酸氢铵将![]() 中的
中的![]() 形成碳酸盐沉淀,试写出化学方程式:____。
形成碳酸盐沉淀,试写出化学方程式:____。
(3)铁硼矿(主要成分为![]() )可以制得硼酸,试写出铁硼矿与硫酸反应的化学方程式:___。
)可以制得硼酸,试写出铁硼矿与硫酸反应的化学方程式:___。
(4)工业上用软锰矿(主要成分![]() )制备锰酸钾。写出
)制备锰酸钾。写出![]() 、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:___。
、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:___。
(5)将氨气通入石灰乳,加入溴,于65℃进行反应也可制得溴化钙,此反应中还生成一种无色气体,写出反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1 mol·L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。下列有关说法正确的是( )
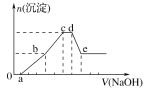
A.在0~a段加入的NaOH溶液与NH4Cl反应
B.在b~c段加入NaOH溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓
C.在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-===AlO2-+2H2O
D.在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组制取氯气并进行氯气的性质实验,其装置如图所示,回答下列问题:
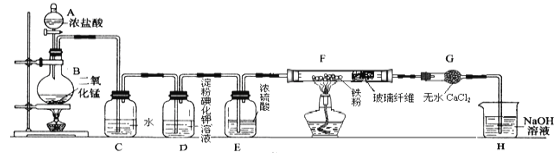
(1)仪器A的名称是 ______,实验中制备氯气的反应方程式为 ____________________。
(2)C中发生反应的化学方程式为 ______ .若将干燥的有色布条放入C中,观察到的现象是 ______,原因是 ___________________________。
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,写出D装置中发生反应的离子方程式______________________。
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解, 100℃左右时升华.双通管F中玻璃纤维(不参与反应)的作用是 ______ ;在F和H装置之间安装G装置的目的是____。
(5)H中NaOH溶液的作用是 _______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是 ( )
A. 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+ = AgBr↓
B. 用醋酸除去水垢:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
C. 苯酚钠溶液通入少量CO2:![]()
D. 实验室用液溴和苯在催化剂作用下制溴苯: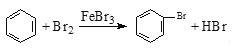
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com