
 现有A、B、C三种物质,均含同一种元素,一定条件下其转化关系如下(部分产物已略去):
现有A、B、C三种物质,均含同一种元素,一定条件下其转化关系如下(部分产物已略去):

科目:高中化学 来源: 题型:
| A、升高温度可减小反应速率 |
| B、加入合适的催化剂可提高反应速率 |
| C、达到平衡时,v(正)=v(逆)=0 |
| D、达到平衡时,NO2转化率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于水 |
| B、酸雨指25℃时pH值小于7的降水 |
| C、加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水 |
| D、发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
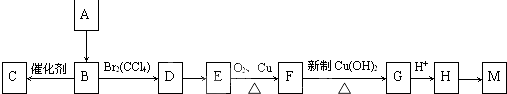
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②④①③ |
| C、①③④ | D、②①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com