
【题目】咖啡酸具有止血功效, 存在于多种中药中, 其结构简式如下图, 则下列有关说法正确的是
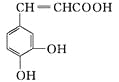
A. 该物质苯环上的一氯代物有2种
B. 1 mol该物质可以与1.5 mol碳酸钠溶液反应生成1.5 mol的CO2
C. 既能发生取代反应, 也能发生加成反应
D. 所有碳原子不可能都在同一个平面上
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知ΔH大于0表示吸热反应;ΔH小于0表示放热反应。关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节诱发关节疼痛,其化学机理为:①HUr(尿酸)+H2O![]() Ur-(尿酸根离子)+H3O+;②Ur-(aq)+Na+(aq)
Ur-(尿酸根离子)+H3O+;②Ur-(aq)+Na+(aq)![]() NaUr(s)下列对反应②的叙述中正确的是( )
NaUr(s)下列对反应②的叙述中正确的是( )
A. 反应的ΔH>0 B. 降低温度,平衡向逆反应方向移动
C. 反应的ΔH<0 D. 升高温度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种抗心肌缺血药物的中间体,可以通过以下方法合成:
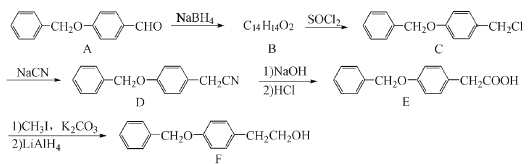
(1)化合物A中的含氧官能团为_________和___________(填官能团的名称)。
(2)化合物B的结构简式为________;由C→D的反应类型是:_______。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式_________。
Ⅰ.分子含有2个苯环 Ⅱ.分子中含有3种不同化学环境的氢
(4)已知:![]() ,请写出以
,请写出以![]() 为原料制备化合物X(结构简式见图
为原料制备化合物X(结构简式见图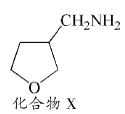 )的合成路线流程图(无机试剂可任选)_________。合成路线流程图示例如下:
)的合成路线流程图(无机试剂可任选)_________。合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2可以用Fe(NO3)3溶液吸收,按如图所示装置展开相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。回答下列问题:
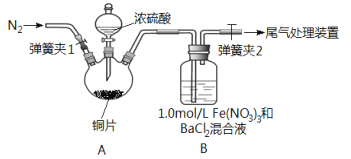
(i)装置A中用于添加浓硫酸的仪器名称为_________________。
(2)实验开始前需进行的操作是_____________________。
(3)加入浓硫酸之前先通入N2一段时间,其目的是_____________________。
(4)排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是_______;若用NaOH溶液处理尾气,则发生反应的离子方程式为_________________。
(5)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加);假设1:装置A中白雾进入装置B中参与了反应;
假设2:______________;
假设3: Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2。
(6)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0mol/LFe(NO3)3溶液的pH ②取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中 (3)________________ ④向试管中通入适量SO2气体 | _____________ |
(7)若假设2正确,请写出B中发生反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基香兰素是一种合成香料,其结构简式如图:
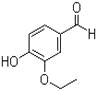
(1)以下推测正确的是___;
a.从分子结构上看,它属于芳香烃
b.该物质能与FeCl3溶液发生显色反应
c.该物质能与碳酸钠溶液反应产生CO2气体
d.一定条件下,1mol该物质最多能与4molH2发生加成反应
(2)R物质是乙基香兰素的同分异构体,性质如下:

试写出任意一种符合上述条件的R的同分异构体的结构简式__________。
(3)X也是乙基香兰素的同分异构体,其可以发生如下反应:

(Ⅰ)X的结构简式______________;B中含氧官能团的名称________________;
(Ⅱ)反应①的反应类型___________、化合物C的分子式为__________;
(Ⅲ)反应④的试剂是NaOH的水溶液;反应④的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2 和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品。
(1)写出氯碱工业中电解饱和食盐水的离子方程式:________________;某学习小组为了测定电解后所得溶液NaOH的浓度,设计了如下实验操作步骤:
①取电解后的溶液10.00mL,加水稀释至100mL;
②量取20.00mL于洁净的锥形瓶,滴加2~3滴酚酞试剂;
③用浓度为0.1010mo/L的标准HCl滴定至终点并记录滴定管的读数为25.00mL
请回答有关问题
①步骤①可能用到的仪器除移液管外,还有_______________
②滴定终点的现象是____________,此溶液中c(Na+)______c(Cl-)(填“<”、“>”或“=”)
③下列操作可能导致所得浓度偏大的是______________
a. 锥形瓶用待测溶液润洗 b.碱式滴定管用待测液润洗
c. 滴定管滴定前有气泡,滴定后无气泡 d. 滴定终点俯视读数
④该实验设计存在的明显不足的是____________
(2)已知:H2SO3的Ka1=1.54×10–2,Ka2=1.02×10–7;HClO的Ka=2.95×10–8
①室温下,0.1 mol·L–1 NaClO溶液的pH_____ 0.1 mol·L–1 Na2SO3溶液的pH。(填“大于”、“小于”或“等于”)
②写出一种可以证明NaHSO3溶液中HSO3–的电离程度大于HSO3–水解程度的方法:_____
(3)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

电解时发生反应的化学方程式为_______________________,溶液X的溶质主要是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
⑴过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。

①装置A中发生反应的化学方程式为______。
②仪器X的名称为______;Y是______。
③为提高CaO2·8H2O产率,装置B的温度需控制在0℃,可采取的方法是______。
⑵测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取0.5000 g产品于有塞锥形瓶中,加入适量蒸馏水和过量的KI晶体,再滴入2 mol·L—1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴淀粉溶液,逐滴加入浓度为0.200 mol·L—1的Na2S2O3溶液至反应完全,滴定至终点,消耗Na2S2O3溶液体枳为20.00 mL。求产品中CaO2·8H2O的质量分数。(写出计算过程)_____________
已知:CaO2·8H2O+2KI+2H2SO4=CaSO4+2K2SO4+I2+10H2O
I2+2S2O32-=2I-+ S4O62-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com