
【题目】已知SO2可以用Fe(NO3)3溶液吸收,按如图所示装置展开相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。回答下列问题:
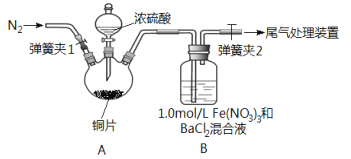
(i)装置A中用于添加浓硫酸的仪器名称为_________________。
(2)实验开始前需进行的操作是_____________________。
(3)加入浓硫酸之前先通入N2一段时间,其目的是_____________________。
(4)排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是_______;若用NaOH溶液处理尾气,则发生反应的离子方程式为_________________。
(5)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加);假设1:装置A中白雾进入装置B中参与了反应;
假设2:______________;
假设3: Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2。
(6)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0mol/LFe(NO3)3溶液的pH ②取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中 (3)________________ ④向试管中通入适量SO2气体 | _____________ |
(7)若假设2正确,请写出B中发生反应的离子方程式:_________________。
【答案】 分液漏斗 检查装置的气密性 排除空气的干扰 饱和NaHSO4溶液 SO2+2OH-==SO32-+H2O SO2被Fe3+氧化为SO42- 向试管中滴加少许稀硝酸,调节pH与①相同 若有白色沉淀,则假设3成立;反之,则假设3不成立 2Fe3++SO2+2H2O==2Fe2++SO42-+4H+ Ba2++SO42-==BaSO4↓
【解析】(1)根据装置构造可知该仪器名称是分液漏斗;(2)实验开始前需进行的操作是检查装置的气密性;(3)装置中含有空气,空气中氧气能氧化亚铁离子干扰实验,所以通入氮气的目的是排除空气的干扰;(4)排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,C中盛放的物质能吸收硫酸且不能吸收二氧化硫、不能引进新的杂质,则需要饱和NaHSO3溶液;二氧化硫属于酸性氧化物,能和碱溶液发生反应生成盐和水,离子方程式为SO2+2OH-==SO32-+H2O;(5)铁离子具有氧化性、二氧化硫具有还原性,二者发生氧化还原反应生成硫酸根离子,因此假设3是SO2被Fe3+氧化为SO42-;(6)要验证假设3,硝酸铁是强酸弱碱盐,其溶液呈酸性,要证明是酸性条件下硝酸根离子氧化二氧化硫,可以用硝酸的强碱盐溶液、少量稀硝酸,然后向溶液中通入少量二氧化硫观察实验现象,第三步操作是向试管中滴加少许稀硝酸,调节pH与①相同;通过以上一系列操作,如果溶液中有白色沉淀生成就说明假设3成立,否则假设3不成立;(7)铁离子把SO2氧化为硫酸,硫酸与氯化钡反应产生白色沉淀,反应的离子方程式为2Fe3++SO2+2H2O==2Fe2++SO42-+4H+、Ba2++SO42-==BaSO4↓。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”![]() 假设盐分以一个NaCl计
假设盐分以一个NaCl计![]() ,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )

A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为![]() 设冰的密度为
设冰的密度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C是一种合成树脂,高分子化合物,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:

(1)写出A的电子式:____________;D的结构简式为____________。
(2)写出碳化钙与水反应制取A的化学方程式: _______________________。
(3)写出由B生成C的化学方程式: __________________,其反应类型为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的恒温恒容密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L。则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L。则下列判断正确的是
A. c1:c2=1:2 B. 平衡时,Y和Z的生成速率之比为2:3
C. 若反应正向进行,X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2常用于催化剂。某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。

已知:①在浓硫酸存在下,加热到140℃时乙醇脱水生成乙醚(C2H5OC2H5),加热到170℃时乙醇脱水生成CH2 = CH2。
②乙醚的熔点为34.6℃,沸点为132℃。
③Mg和Br2剧烈反应,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5 ![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,让液溴缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤反应物,将得到的滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,减压过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
回答下列问题:
(1)装置A中使用仪器m的优点是________。
(2)步骤I中所选装置的正确连接顺序是a________ (填小写字母)。装置D的作用是________。
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是________。
(4)步骤V中用苯洗涤三乙醚合溴化镁的目的是________。
(5)步骤V采用减压过滤(使容器内压强降低,以达到固液快速分离)。下列装置可用作减压过滤的是________(填序号)。

(6)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请设计实验验证 CH2Br—CH2Br的存在:从反应后的混合物中分离提纯得到CH2Br—CH2Br,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效, 存在于多种中药中, 其结构简式如下图, 则下列有关说法正确的是
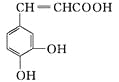
A. 该物质苯环上的一氯代物有2种
B. 1 mol该物质可以与1.5 mol碳酸钠溶液反应生成1.5 mol的CO2
C. 既能发生取代反应, 也能发生加成反应
D. 所有碳原子不可能都在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在化工生产中有着广泛的应用。
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。部分技术流程如下:
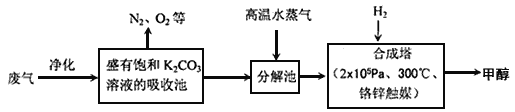
(1)吸收池中反应的化学方程式为K2CO3+CO2+H2O=2KHCO3,△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,其原因是 ____________________,_________________________
(2)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式_____________。
II.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(1)从反应开始到20min时,以CO表示反应速率为___________________
(2)下列描述能说明反应达到平衡![]() 是_______
是_______
A.装置内CO和H2的浓度比值不再改变
B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变
D.容器内气体密度保持不变
(3)该温度下平衡常数K=_______,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将_________ (填“增大”、“减小”或“不变”)
(4)该反应达到平衡后,再向容器中充入1mol CO和2mol H2,此时CO的转化率将_____(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于取代反应的是
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.nCH2=CH2![]()
![]()
C.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工产品,在生产和科研中应用广泛,氢气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:
途径一、用水和天然气作原料一步反应制得
途径二,用煤和水作原料经多步反应制得
请回答下列问题:
(1)途径一反应的还原产物是______。
(2)途径二中的一步反应为:![]()
①上述反应达到平衡后,为提高CO的转化率,下列措施中正确的是______![]() 填写序号
填写序号![]() 。
。
A.增大压强 ![]() 降低温度
降低温度 ![]() 增大
增大![]() 的浓度
的浓度 ![]() 使用催化剂
使用催化剂
②已知1000K时,上述反应的平衡常数![]() ,若要使CO的转化率超过
,若要使CO的转化率超过![]() ,则起始时
,则起始时![]() :
:![]() 不低于______。
不低于______。
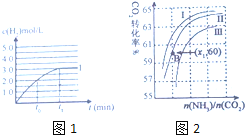
③在容积为2L的容器中发生上述反应,测得![]() 与反应时间t的变化曲线Ⅰ如图1所示,若在
与反应时间t的变化曲线Ⅰ如图1所示,若在![]() 时刻将容器的体积扩大至4L,请在答题卡图中绘出
时刻将容器的体积扩大至4L,请在答题卡图中绘出![]() 与反应时间变化的曲线Ⅱ。____________
与反应时间变化的曲线Ⅱ。____________
(3)目前常用氨气处理硝酸生产的工业尾气,在![]() 左右且有催化剂存在的情况下,氨气能把
左右且有催化剂存在的情况下,氨气能把![]() 还原成无色无毒气体,直接排入空气中,已知氢气的燃烧热为
还原成无色无毒气体,直接排入空气中,已知氢气的燃烧热为![]() ,
,![]() ,
,![]() 。试写出氨气与
。试写出氨气与![]() 反应生成无毒气体和液态水的热化学方程式______。
反应生成无毒气体和液态水的热化学方程式______。
(4)工业上用氨和二氧化碳反应合成尿素,其反应为:CO2+2NH3=CO(NH2)2+H2O;![]() 生成过程中,原料气常混有水蒸气,
生成过程中,原料气常混有水蒸气,![]() 的转化率与氨碳比
的转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系如图2所示:
的变化关系如图2所示:
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最小的是______。
②若B点氨的转化率为![]() ,则
,则![]() ______。
______。
(5)某同学将![]() 和
和![]() 按物质的量之比2:1通入水中,充分反应所得溶液中
按物质的量之比2:1通入水中,充分反应所得溶液中![]() 、
、![]() 、
、![]() 三种离子浓度由大到小的顺序是______
三种离子浓度由大到小的顺序是______![]() 已知:氨水、碳酸的电离平衡常数如表
已知:氨水、碳酸的电离平衡常数如表![]()
弱电解质 | 化学式 | 电离常数 |
氨水 |
|
|
碳酸 |
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com