
����Ŀ��[��ѧ��ѡ���л���ѧ����]
������F�Ǻϳɿ�����ʧ��ҩ��������ص��м������Ա�Ϊԭ�Ϻϳ�F��·������:
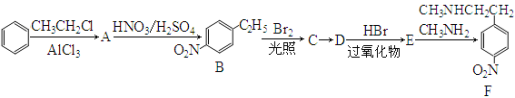
��֪����CH3CH=CH2![]() CH3CHBrCH3 ��CH3CH=CH2
CH3CHBrCH3 ��CH3CH=CH2![]() CH3CH2CH2Br
CH3CH2CH2Br
�Իش���������
��1������Aת���ķ�Ӧ������ ��
��2��������C��Dת���ķ�Ӧ����ͨ���� ��������D ������ڡ����������ڡ���˳���칹����֪������C�ĺ˴Ź���������ʾ�����ַ壬�ҷ�������Ϊ2�U2�U1�U3����C�Ľṹ��ʽΪ ��
��3��д��E��Fת���Ļ�ѧ����ʽ ��
��4������B��ͬ���칹���ж��֣���������������ͬ���칹�干�� �֡�
�����ڷ����廯����
�ڷ��ӽṹ��û�м������а���
���ܷ���������Ӧ��ˮ�ⷴӦ��������NaOH��Ӧ�����ʵ���֮��Ϊ1�U2
��5������ͪ��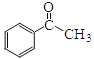 ���������л���ѧ�ϳɵ��м��壬���������ϳ�F�IJ��ֲ��裬���һ���Ա�Ϊ��ʼԭ���Ʊ�����ͪ�ĺϳ�·�� ��
���������л���ѧ�ϳɵ��м��壬���������ϳ�F�IJ��ֲ��裬���һ���Ա�Ϊ��ʼԭ���Ʊ�����ͪ�ĺϳ�·�� ��
���𰸡���1��ȡ����Ӧ
��2��NaOH����Һ������ ������ ![]()
��3��![]() ��CH3NH2
��CH3NH2![]() ��HBr
��HBr
��4��3
��5��
��������
�����������1������һ�����鷴Ӧ���ڱ����������һ���˵��Ϊȡ����Ӧ��
��2��C��D��±��������ȥ��Ӧ������ΪNaOH����Һ�ͼ��ȣ�������D������ϩ����������˳���칹��C�ĺ˴Ź���������ʾ�����ַ壬��˵����������ԭ�ӣ���ṹΪ![]() ��
��
��3��E��F�Ƿ�����ȡ����Ӧ������ʽΪ
![]() ��CH3NH2
��CH3NH2![]() ��HBr��
��HBr��
��4��������B��ͬ���칹��������Ҫ����ܷ���������Ӧ��ˮ�ⷴӦ��˵�����м������������������Ʒ�Ӧ�����ʵ�����Ϊ1:2������ˮ���������ǻ���˵���ṹ������������ ���ֱ�Ϊ-CH2NH2��-OOCH�����������ڱ����Ͽ������ڼ������λ�ù�ϵ��������3�ֽṹ��
��5�������Ʒ���������Ҫ�����ʻ�����Ҫ�ȳ����ǻ�������������Ӧ���ɣ����ǻ��ij�������±����ˮ�����ɵģ���±��������������±���ڹ��������·���ȡ����Ӧ�õ��ģ��������ڱ����������һ��������ұ������ڹ���������ȡ���м�̼ԭ���ϵ���ԭ�����ɴ������������ɣ��������£�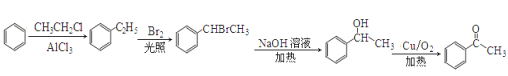 ��
��


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������ճ�������������Ҫ�����ã������й�˵������ȷ������ ��
A�������Ƶ�ˮ��Һ�׳�ˮ������������ľ�ķ����
B�����ع��͡������ӹ��������������Ʒ���
C��������ˮ�Ǻܺõķ��ϣ��ɹ��ׯ�ڣ���ֱ���ŷŵ���Ȼ��ˮ����
D��Fe2O3������������ɫ�����Ϳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A��ԭ����ǻ�ѧ��Դ�ij���
B���ж�һ�ֵ�ص�������Ҫ�ǿ��为���Ļ�����
C������ԭ��ص�ԭ����Ƴ��˻�ѧ��Դ
D��������ԭ��Ӧ���ͷŵĻ�ѧ���ǻ�ѧ��Դ��������Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ۡ������ʡ�������ˮ��Һ�����οɷֱ�ʹ�õ��Լ��Ͷ�Ӧ��������ȷ����( )
A����ˮ������ɫ ������Cu(OH)2��ש��ɫ������Ũ���ᣬ���ɫ
B��Ũ���ᣬ���ɫ ������Cu(OH) 2��ש��ɫ��������ˮ������ɫ
C������Cu(OH)2��ש��ɫ��������ˮ������ɫ��Ũ���ᣬ���ɫ
D����ˮ������ɫ �� Ũ���ᣬ���ɫ ������Cu(OH)2��ש��ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯�����ڿ��м������о�������Ҫ��Ӧ�á�
��1������P(s)��Cl2 (g)������Ӧ����PCl3(g)�� PCl5(g)����Ӧ�������¡�
2P(s) + 3Cl2(g) = 2PCl3(g) ��H=��612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) ��H=��798kJ/mol
��̬PCl5������̬PCl3��Cl2���Ȼ�ѧ����ʽΪ ��
��2�����淴ӦPCl3(g)+Cl2(g)![]() PCl5(g) 2E(g)
PCl5(g) 2E(g)![]() F(g)+G(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮���пɻ�������Ħ�����ܷ���塣��Ӧ��ʼ�ʹﵽƽ��ʱ�й��������仯��ͼ��ʾ��
F(g)+G(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮���пɻ�������Ħ�����ܷ���塣��Ӧ��ʼ�ʹﵽƽ��ʱ�й��������仯��ͼ��ʾ��
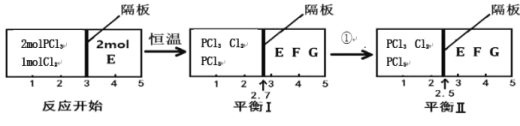
�ٴﵽƽ��Iʱ����ϵѹǿ�뷴Ӧ��ʼʱ��ϵѹǿ֮��Ϊ ��
��ƽ��I��ƽ��II���������� ������¡����¡�����
��3�������ᣨH3PO3����������NaOH��Һ��Ӧ����Na2HPO3�����Na2HPO3��ҺҲ�ɵõ������ᣬװ����ͼ��ʾ��

�����ĵ缫��ӦʽΪ________________����Ʒ���з�Ӧ�����ӷ���ʽΪ ��
��4��һ���¶��£�Ksp [Mg3(PO4)2] =6.0��10-29��Ksp [Ca3(PO4)2] =6.0��10-26����Ũ�Ⱦ�Ϊ0.20 mol��L��1��MgCl2��CaCl2�����Һ����μ���Na3PO4�������� �������ѧʽ�����������Һ����һ�ֽ��������ӳ�����ȫ��Ũ��С��10-5mol/L��ʱ����Һ�е���һ�ֽ��������ӵ����ʵ���Ũ��c= mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȼ�ϵ��Ϊ��Դ���е���ʵ��װ����ͼ��ʾ������˵����ȷ����
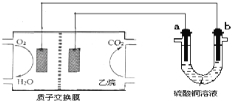
A��ȼ�ϵ�ع���ʱ��������ӦΪO2+2H2O+4e���T 4OH��
B��a����ͭ��b������ʱ������ͭ��ҺŨ�ȼ�С
C��a��b��������ʯī����ͬ��ͬѹ��a���������������������ĵ���������ı�Ϊ7/2
D��a���Ǵ�ͭ��b���Ǵ�ͭʱ��a������ͭ������b�����ܽ⣬���������仯��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϩ���������ӳɺ�õ�2��2���������飬ϩ����������
A. 2��2��������3����ϩ B. 2��2��������4����ϩ
C. 4��4��������2����ϩ D. 2��2��������2����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��mA(g)��nB(g) ![]() pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
��1���÷�Ӧ���淴ӦΪ________�ȷ�Ӧ����m��n______p (�����������������) ��
��2����ѹʱ��A����������__________��(���������С�����䡱����ͬ)
��3�����ݻ��������B����B��ת����__________��
��4���������¶ȣ���ƽ��ʱB��C��Ũ��֮�Ƚ�__________��
��5�������������ƽ��ʱ��������������ʵ���__________��
��6����B����ɫ���ʣ�A��C����ɫ�������C(�������)ʱ�������ɫ__________����ά��������ѹǿ���䣬��������ʱ���������ɫ ��(����������dz�����䡱)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
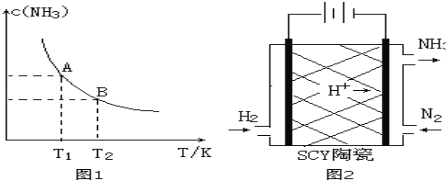
����Ŀ����1����һ�������£���1.00molN2��g����3.00molH2��g�������һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3��g����ƽ��Ũ����ͼ1��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��
�����¶���T1�仯��T2ʱ��ƽ�ⳣ����ϵK1 K2�����������������=�������ʱ���H 0���������������
���÷�Ӧ��T1�¶���5.00min�ﵽƽ�⣬���ʱ����N2�Ļ�ѧ��Ӧ����Ϊ ��
��T1�¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K1= ��
��2���������¡��˹��̵������о��������ڳ��³�ѹ����������N2�ڴ���������ˮ������Ӧ��2N2��g��+6H2O��l��=4NH3��g��+3O2��g�����˷�Ӧ����S 0�������������������֪��N2��g��+3H2��g��=2NH3��g����H=a kJ/mol 2H2��g��+O2��g��=2H2O��l����H=b kJ/mol 2N2��g��+6H2O��l��=4NH3��g��+3O2��g������H= ���ú�a��b��ʽ�ӱ�ʾ����
��3����ѧ�Ҳ������Ӹߵ����Ե�SCY�մɣ��ɴ���H+��ʵ���˵��³�ѹ�¸�ת���ʵĵ绯ѧ�ϳɰ�����ʵ��ԭ��ʾ��ͼ��ͼ2��ʾ���������ĵ缫��Ӧʽ�� ��
��4����֪ijЩ���������ˮ�еĵ���ƽ�ⳣ����25�������±���
������� | H2CO3 | NH3.H2O |
����ƽ�ⳣ�� | Ka1=4.30��10-7 Ka2=5.61��10-11 | Kb=1.77��10-5 |
���г�����0��1 mol��L-1�ģ�NH4��2CO3��Һ��
������Һ�� �ԣ���ᡱ�����С����������ԭ���� ��
���ã�NH4��2CO3��Һ�и���Ũ��֮��Ĺ�ϵʽ����ȷ���� ��
A��c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B��c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C��c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D��c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E��c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com