
【题目】已知:反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1的平衡常数为K1;
反应②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2的平衡常数为K2。
反应③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3的平衡常数为K3。
不同温度时K1、K2的值如下表,下列说法正确的是 ( )

A.K3=K1-K2
B.K3=K1+K2
C.ΔH3>0
D.ΔH3<0
科目:高中化学 来源: 题型:
【题目】S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组拟设计 实验制备少量的S2Cl2,査阅资料知:
①干燥的氯气在 110℃~140℃与硫反应,即可得到 S2Cl2。
②S 的熔点为 112.8℃、沸点为 444.6℃;S2Cl2 的熔点为-76℃、沸点为 138℃。
③S2Cl2+Cl2![]() 2SCl2。
2SCl2。
④S2Cl2 易和水发生歧化反应。

该小组设计的制备装置如如图(夹持仪器和加热装置已略去)
(1)连接好实验装置后的第一步实验操作是____________。
(2)A 装置中制取氯气的离子反应方程式_____________。
(3)装置 B、C 中的试剂分别是_____________,_____________; 若实验中缺少 C 装置,发现产品浑浊不清,请用化学方程式表示其原因____________。
(4)该实验的操作顺序应为_____________(用序号表示)。
①加热装置 A ②加热装置 D ③通冷凝水 ④停止加热装置 A ⑤停止加热装置 D
(5)图中 G 装置中应放置的试剂为______________,其作用为______________。
(6)在加热 D 时温度不宜过高,其原因是_______________; 为了提高 S2Cl2 的纯度,关键的操作是控制好温度和______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油的成分之一,它的结构简式是![]() ,下列叙述中不正确的是 ( )
,下列叙述中不正确的是 ( )
A.1 mol胡椒酚最多可与4 mol H2发生反应
B.1 mol胡椒酚最多可与4 mol Br2发生反应
C.胡椒酚可与NaOH溶液反应
D.胡椒酚在水中的溶解度不大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:

关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
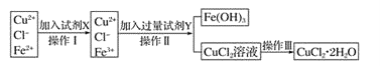
请参照下表给出的数据填空。

(1)操作I加入X的目的是___________________________ 。
(2)下列物质都可以作为X,适合本实验的X物质可以是_________(填字母)。
A KMnO4 B NaClO C H2O2 D Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)__________________________________________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 聚乙烯不能使酸性KMnO4溶液褪色
B. ![]() 和
和 ![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
C. ![]() 和
和![]() 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
D. 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
![]() 航天领域中常用
航天领域中常用![]() 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。![]() 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱![]() 用电离方程式表示
用电离方程式表示![]() 显碱性的原因是:________________。
显碱性的原因是:________________。
![]() 在恒温条件下,
在恒温条件下,![]() 和足量C发生反应
和足量C发生反应![]() ,测得平衡时
,测得平衡时![]() 和
和![]() 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
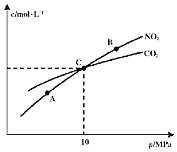
![]() 、B两点的浓度平衡常数关系:
、B两点的浓度平衡常数关系:![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() 、B、C三点中
、B、C三点中![]() 的转化率最高的是______
的转化率最高的是______![]() 填“A”或“B”或“C”
填“A”或“B”或“C”![]() 点。
点。
![]() 计算C点时该反应的压强平衡常数
计算C点时该反应的压强平衡常数![]() ______
______![]() 是用平衡分压代替平衡浓度计算,分压
是用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 已知:亚硝酸
已知:亚硝酸![]() 性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数
性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数![]() ;
;![]() 的
的![]() ,
,![]() 在常温下向含有2mol碳酸钠的溶液中加入1mol的
在常温下向含有2mol碳酸钠的溶液中加入1mol的![]() 后,则溶液中
后,则溶液中![]() 、
、![]() 和
和![]() 的离子浓度由大到小的顺序是______。
的离子浓度由大到小的顺序是______。
![]() 已知:常温下甲胺
已知:常温下甲胺![]() 的电离常数为
的电离常数为![]() ,且
,且![]() 水溶液中有
水溶液中有![]() ,常温下向
,常温下向![]() 溶液滴加稀硫酸至
溶液滴加稀硫酸至![]() 时,则溶液
时,则溶液![]() ______。
______。
![]() 一种煤炭脱硫技术可以把硫元素以
一种煤炭脱硫技术可以把硫元素以![]() 的形成固定下来,但产生的CO又会与
的形成固定下来,但产生的CO又会与![]() 发生化学反应,相关的热化学方程式如下:
发生化学反应,相关的热化学方程式如下:![]()
![]()
![]() ,反应
,反应![]() ______
______![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24L苯中含C-H数目为0.6 NA
B.常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA
C.常温下,1.0LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
D.在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如下:
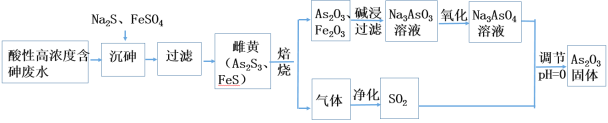
回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为________,“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是_________________________________。(写名称)
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为:_______________。
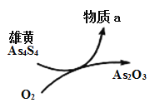
(5)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)
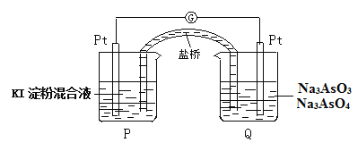
(6)某原电池装置如图,电池总反应为:AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com