
【题目】某活动小组利用废铁屑(含少量S等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4 ·6H2O](M=392g/mol),设计如图所示装置(夹持仪器略去)。

称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50 ~60°C热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)在实验中选择50~60℃热水浴的原因是___________________。
(2)装置B的作用是_______________________________。
(3)检验制得的(NH4)2SO4·FeSO4·6H2O中是否含有Fe3+的方法:将硫酸亚铁铵晶体用加热煮沸过的蒸馏水溶解,然后滴加________________(填化学式)。
(4)产品中杂质Fe3+的定量
①配制Fe3+浓度为0.1 mg/mL的标准溶液100mL。称取________(精确到0.1)mg高纯度的硫酸铁铵[(NH4)Fe(SO4)2·12H2O],加入20.00 mL经处理的去离子水。振荡溶解后,加入2 mol·L-1HBr溶液1mL和1mol·L-1KSCN溶液0.5mL,加水配成100mL溶液。
②将上述溶液稀释成浓度分别为0.2、1.0、 3.0、5.0、 7.0、 10.0(单位: mg·L-1)的溶液。分别测定不同浓度溶液对光的吸收程度(吸光度),并将测定结果绘制成如图所示曲线。取硫酸亚铁铵产品,按步骤①配得产品硫酸亚铁铵溶液10mL,稀释至100mL,然后测定稀释后溶液的吸光度,两次测得的吸光度分别为0.590、0.610,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为_______mg·L-1。

(5)称取mg产品,将产品用加热煮沸的蒸馏水溶解,配成250mL溶液,取出100mL放入锥形瓶中,用c mol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为___________(用含c、V、m的代数式表示,化简)。滴定时,下列滴定方式中,最合理的是___________(填字母)。
A.  B.
B.  C.
C. 
若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,实验结果将会_________(填“偏大”“偏小”或“无影响”。)
【答案】加快反应速率,受热均匀 防止倒吸 KSCN溶液 86.1 85 ![]() B 无影响
B 无影响
【解析】
⑴在实验中选择50~60℃热水浴,升高温度,受热均匀,加快反应速率,提高利用率。
⑵装置A中有部分挥发出的氨气,氨气极易溶于水。
⑶检验溶液中含有Fe3+的方法主要是加入KSCN溶液。
⑷①先计算100mL中的m(Fe3+),再根据Fe3+ ~NH4Fe(SO4)212H2O得到NH4Fe(SO4)212H2O的质量。
②两次吸光度求得平均值,根据图中信息得到溶液中Fe3+浓度,再求10mL所配产品硫酸亚铁铵溶液中所含Fe3+浓度。
⑸根据5Fe2+ ~KMnO4关系式得硫酸亚铁铵晶体的纯度;滴定时,是高锰酸钾溶液向试样中滴定,高锰酸钾是强化性溶液,易腐蚀橡皮管,用酸式滴定管滴加;若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,溶质无变化。
⑴在实验中选择50~60℃热水浴,升高温度,受热均匀,加快反应速率,提高利用率,故答案为:加快反应速率,受热均匀。
⑵装置A中有部分挥发出的氨气,氨气极易溶于水,因此装置B的作用是防倒吸,起安全瓶的作用;故答案为:防止倒吸。
⑶检验溶液中含有Fe3+的方法主要是加入KSCN溶液,故答案为:KSCN溶液。
⑷①配制Fe3+浓度为0.1 mgmL1的标准溶液100mL。则m(Fe3+)=0.1 mgmL1 ×100mL = 10mg,根据Fe3+ ~NH4Fe(SO4)212H2O得到NH4Fe(SO4)212H2O的质量为![]() ;故答案为:86.1。
;故答案为:86.1。
②两次测得的吸光度分别为0.590、0.610,两次吸光度的平均值为0.600,根据图中信息得到稀释至100mL,溶液中Fe3+浓度为8.5mgL1,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度![]() ;故答案为:85。
;故答案为:85。
⑸称取mg产品,将产品用加热煮沸的蒸馏水溶解,配成250mL溶液,取出100mL放入锥形瓶中,用c molL1 KMnO4溶液滴定,消耗KMnO4溶液VmL,根据5Fe2+ ~KMnO4关系式得硫酸亚铁铵晶体的纯度![]() ,滴定时,是高锰酸钾溶液向试样中滴定,高锰酸钾是强氧化性溶液,易腐蚀橡皮管,用酸式滴定管滴定,因此滴定方式中最合理的是B;若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,溶质无变化,因此对实验结果无影响;故答案为:
,滴定时,是高锰酸钾溶液向试样中滴定,高锰酸钾是强氧化性溶液,易腐蚀橡皮管,用酸式滴定管滴定,因此滴定方式中最合理的是B;若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,溶质无变化,因此对实验结果无影响;故答案为:![]() ;B;无影响。
;B;无影响。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数用NA表示,下列叙述正确的是
A.18克液态水与18克冰中氢键数目均为NA
B.工业酸性废水中的Cr2O72-可转化为Cr3+除出,现用电解的方法模拟该过程,阴极为石墨,阳极为铁,理论上电路中每通过6mol电子,就有NA个Cr2O72-被还原
C.标准状况下,22.4LNO2含有的原子数小于3NA
D.1molLiAlH4在125℃完全分解成LiH、H2、Al,转移电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是( )
2NH3(g)△H=-92.4kJ/mol,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是( )
A.A中放热92.4kJ
B.B中放热46.2kJ
C.A中热量变化值大于B中2倍
D.A中热量变化值等于B中的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关有机物的说法正确的是
A.1mol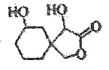 最多能消耗3 mol NaOH,不能与H2加成
最多能消耗3 mol NaOH,不能与H2加成
B.辛酸的同分异构体(CH3)3CCH (CH3) CH2COOH的名称为2,2,3-三甲基戊酸
C.1,3,5-三甲苯的二氯代物有5种
D.异丙苯和对甲乙苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时, 向一定浓度的Na2C2O4溶液中滴加盐酸,混合溶液的pH与离子浓度变化关系如图所示。已知H2C2O4是二元弱酸,X表示 或
或![]() 下列叙述错误的是
下列叙述错误的是

A.直线n表示pH与- lg 的关系
的关系
B.从M点到N点的过程中,c(H2C2O4)逐渐增大
C.pH= 4.18的混合溶液中: c(Na+)>c(HC2O4-)= c(C2O42-)=(C1-)> c(H+)> c(OH-)
D.由N点可知Kal(H2C2O4)的数量级为10-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。电池总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法正确的是( )

A.左电极为电池的负极,a处通入的物质是空气
B.右电极为电池的负极,b处通入的物质是甲醇
C.正极反应式为:O2+2H2O-4e-=4OH-
D.负极反应式为:CH3OH+H2O-6e-=CO2+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1;
②C(s)+O2(g)=CO2(g) ΔH2;
③2H2(g)+O2(g)=2H2O(l) ΔH3;
④2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) ΔH4;
⑤2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH5。
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH2<0B.ΔH5=2ΔH2+ΔH3-ΔH1
C.ΔH1<0,ΔH3<0D.ΔH4=ΔH1-2ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
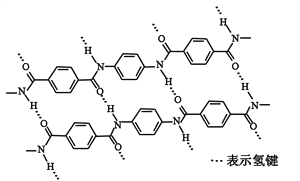
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体的晶胞结构如图所示。
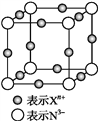
(1)该晶体的阳离子与阴离子个数比为____。
(2)该晶体中Xn+中n=____。
(3)X元素的原子序数是_____。
(4)晶体中每个N3-被____个等距离的Xn+包围。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com