
【题目】已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1;
②C(s)+O2(g)=CO2(g) ΔH2;
③2H2(g)+O2(g)=2H2O(l) ΔH3;
④2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) ΔH4;
⑤2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH5。
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH2<0B.ΔH5=2ΔH2+ΔH3-ΔH1
C.ΔH1<0,ΔH3<0D.ΔH4=ΔH1-2ΔH3
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A. CS2为V形的极性分子
B. ClO3—的空间构型为平面三角形
C. SF6中有6对相同的成键电子对
D. SiF4和SO32—的中心原子均为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)由CO2转化为羧酸是CO2资源化利用的重要方法。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
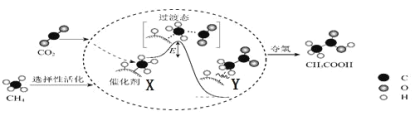
①在合成CH3COOH的反应历程中,下列有关说法正确的是_____。(填字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为_____。
II.电解法转化CO2制HCOOH的原理如图。

①写出阴极CO2还原为HCOO-的电极反应式:_____。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____。
(2)由CO2合成甲醇是CO2资源化利用的重要方法。研究表明在催化剂作用下CO2和H2可发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有_____。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比![]()
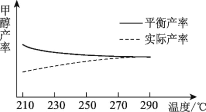
②研究温度对于甲醇产率的影响。在210℃~290℃保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如图所示。ΔH____0(填“>”或“<”),其依据是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组利用废铁屑(含少量S等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4 ·6H2O](M=392g/mol),设计如图所示装置(夹持仪器略去)。

称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50 ~60°C热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)在实验中选择50~60℃热水浴的原因是___________________。
(2)装置B的作用是_______________________________。
(3)检验制得的(NH4)2SO4·FeSO4·6H2O中是否含有Fe3+的方法:将硫酸亚铁铵晶体用加热煮沸过的蒸馏水溶解,然后滴加________________(填化学式)。
(4)产品中杂质Fe3+的定量
①配制Fe3+浓度为0.1 mg/mL的标准溶液100mL。称取________(精确到0.1)mg高纯度的硫酸铁铵[(NH4)Fe(SO4)2·12H2O],加入20.00 mL经处理的去离子水。振荡溶解后,加入2 mol·L-1HBr溶液1mL和1mol·L-1KSCN溶液0.5mL,加水配成100mL溶液。
②将上述溶液稀释成浓度分别为0.2、1.0、 3.0、5.0、 7.0、 10.0(单位: mg·L-1)的溶液。分别测定不同浓度溶液对光的吸收程度(吸光度),并将测定结果绘制成如图所示曲线。取硫酸亚铁铵产品,按步骤①配得产品硫酸亚铁铵溶液10mL,稀释至100mL,然后测定稀释后溶液的吸光度,两次测得的吸光度分别为0.590、0.610,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为_______mg·L-1。

(5)称取mg产品,将产品用加热煮沸的蒸馏水溶解,配成250mL溶液,取出100mL放入锥形瓶中,用c mol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为___________(用含c、V、m的代数式表示,化简)。滴定时,下列滴定方式中,最合理的是___________(填字母)。
A.  B.
B.  C.
C. 
若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,实验结果将会_________(填“偏大”“偏小”或“无影响”。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,向20.00mL0.1mol/L二元弱酸H2X溶液中滴入0.1mol/LNaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-lgc 水(OH-)]与所加NaOH溶液体积的关系如图所示。下列说法中不正确的是
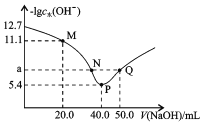
A.M点溶液中:c(Na+)>c(HX-)>c(H2X)
B.P点溶液中: c(OH-)-c(H+)=c(HX-)+2c(H2X)
C.溶液中![]()
D.水的电离程度:P>N=Q>M,且a=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气既是高效洁净的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的ΔH=___kJ·mol-1。
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是___。
N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是___。
a.使用催化剂 b.降低温度 c.及时分离水
(3)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:

①外电路电子移动方向:___。(填“a极到b极”或“b极到a极”)。
②a极电极反应式为___。
③若燃料电池消耗的空气在标准状况下的体积是22.4L(假设空气中O2体积分数为20%),则理论上消耗甲烷___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
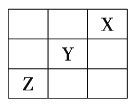
A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 为直线形结构,
为直线形结构,![]() 为平面正三角形结构,
为平面正三角形结构,![]() 为三角锥形结构,请推测COS、
为三角锥形结构,请推测COS、![]() 、
、![]() 的空间构型:______________________________。
的空间构型:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为NaCl和CsCl的晶体结构,下列说法错误的是( )
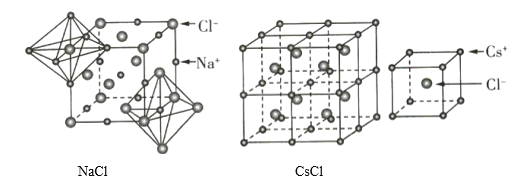
A.NaCl和CsCl都属于AB型的离子晶体
B.NaCl和CsC1晶体中阴、阳离子个数比相同,所以二者的阴、阳离子的配位数也相同
C.CsCl晶体中阴、阳离子的配位数均为8
D.NaCl和CsCl都属于AB型的离子晶体,但阴、阳离子的半径比不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com