
【题目】已知![]() 为直线形结构,
为直线形结构,![]() 为平面正三角形结构,
为平面正三角形结构,![]() 为三角锥形结构,请推测COS、
为三角锥形结构,请推测COS、![]() 、
、![]() 的空间构型:______________________________。
的空间构型:______________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知某温度下:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是( )
2NH3(g)△H=-92.4kJ/mol,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是( )
A.A中放热92.4kJ
B.B中放热46.2kJ
C.A中热量变化值大于B中2倍
D.A中热量变化值等于B中的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1;
②C(s)+O2(g)=CO2(g) ΔH2;
③2H2(g)+O2(g)=2H2O(l) ΔH3;
④2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) ΔH4;
⑤2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH5。
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH2<0B.ΔH5=2ΔH2+ΔH3-ΔH1
C.ΔH1<0,ΔH3<0D.ΔH4=ΔH1-2ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
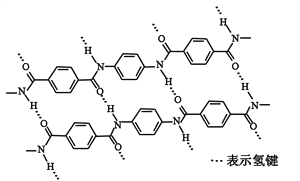
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子的杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A |
|
| 直线形 | 直线形 |
B |
|
| 平面三角形 | 三角锥形 |
C |
|
| 四面体形 | 平面三角形 |
D |
|
| 四面体形 | 正四面体形 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 键和
键和![]() 键的理解不正确的是
键的理解不正确的是![]()
A. ![]() 键可以绕键轴旋转,
键可以绕键轴旋转,![]() 键不能绕键轴旋转
键不能绕键轴旋转
B. ![]() 分子中的
分子中的![]() 键是
键是![]()
![]() 键,HClO分子中的
键,HClO分子中的![]() 键都是
键都是![]()
![]() 键
键
C. ![]() 分子和
分子和![]() 中都是含有5个
中都是含有5个![]() 键
键
D. ![]() 键以“头碰头”方式重叠,
键以“头碰头”方式重叠,![]() 键以“肩并肩”方式重叠
键以“肩并肩”方式重叠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某些共价键的键能如表所示,试回答下列问题:℃
共价键 | 键能 | 共价键 | 键能 |
| 436 |
| 467 |
| 243 |
| 945 |
| 413 |
| 431 |
(1)![]() 键的键能为什么比
键的键能为什么比![]() 键的键能大_______?
键的键能大_______?
(2)已知![]() 在
在![]() 时有
时有![]() 的分子分解,而
的分子分解,而![]() 在
在![]() 时可能完全分解为
时可能完全分解为![]() 和
和![]() ,试解释其中的原因_______。
,试解释其中的原因_______。
(3)试解释氮气能在空气中稳定存在的原因_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体的晶胞结构如图所示。
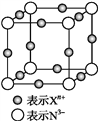
(1)该晶体的阳离子与阴离子个数比为____。
(2)该晶体中Xn+中n=____。
(3)X元素的原子序数是_____。
(4)晶体中每个N3-被____个等距离的Xn+包围。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=—lgc(OH),下列正确的是
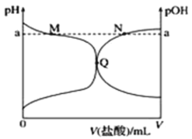
A.M 点所示溶液中可能存在:c(Cl)>c(NH4+)
B.M 点到Q点所示溶液中水的电离程度先变大后减小
C.Q 点盐酸与氨水恰好中和
D.N 点所示溶液中可能存在:c(NH4+)+c(NH3·H2O)=c(Cl)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com