
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子的杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A |
|
| 直线形 | 直线形 |
B |
|
| 平面三角形 | 三角锥形 |
C |
|
| 四面体形 | 平面三角形 |
D |
|
| 四面体形 | 正四面体形 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】碳酸锶是重要的化工基础原料,由工业级硝酸锶(含有Ba2+、Ca2+、Mg2+等杂质)制备分析纯碳酸锶的工艺流程如下:
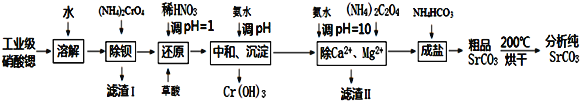
已知:①BaCrO4不溶于水,在水溶液中Cr2O72-与Ba2+不能结合。
②常温下,各物质的溶积常数如下表所示:
化合物 | Ca(OH)2 | CaC2O4 | Mg(OH)2 | MgC2O4 | Cr(OH)3 |
Ksp近似值 | 5.0×10-6 | 2.2×10-9 | 5.6×10-12 | 4.8×10-6 | 10-30 |
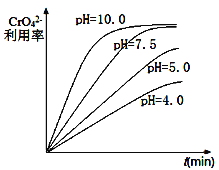
(1)“除钡”过程中CrO42-在不同pH时的利用率随时间变化曲线如下图所示,根据图像分析“除钡”过程中需要调节pH=7.5的原因_______________________________。
(2)“还原”过程中,应先调节pH=1.0,再加入草酸,加入草酸时发生反应的离子方程式为_____________________________。
(3)“滤渣Ⅱ”的主要成分为________________。
(4)“除Ca2+、Mg2+”后得到的滤液中除含有Sr(NO3)2外还含有过量的NH3·H2O,则“成盐”过程中发生反应的离子方程式为__________________________。
(5)“粗品SrCO3”烘干过程中除去的主要杂质为_____________________。
(6)在“中和、沉淀”步骤中,假定开始Cr3+,Zn3+浓度为0.1mol/L,调节至pH为_______时,铬开始沉淀;继续加碱调节至pH为_____时,铬刚好完全沉淀(离子浓度小于1×10-6mol/L时,即可认为该离子沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家发现,在常温常压与可见光照射下,N2与H2O在水滑石(LDH)表面发生反应:2N2(g) + 6H2O(g) ![]() 4NH3(g) + 3O2(g) – Q(Q>0)。关于该过程的说法错误的是
4NH3(g) + 3O2(g) – Q(Q>0)。关于该过程的说法错误的是
A.属于固氮过程
B.太阳能转化为化学能
C.反应物的总能量高于生成物的总能量
D.反应物的总键能高于生成物的总键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志。根据下面转化关系回答问题。

(1)分别写出A和E中官能团的名称:A中_________;E中_________;
(2)操作⑥的名称为________________。
(3)写出反应类型:④_________;
(4)请写出下列反应的化学方程式:
①写出A和B在浓硫酸中加热反应的方程式_________________;
②B在金属铜存在下在空气中加热反应________________;
(5)F是一种常见的高分子材料,它给我们带来了巨大的方便。然而,这种材料造成的当今的某一环境问题是__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸”电池原理如图所示,(电解质溶液为含C2O![]() 的盐溶液,电池总反应为2A1+ 6CO2=Al2(C2O4)3,下列有关说法正确的是
的盐溶液,电池总反应为2A1+ 6CO2=Al2(C2O4)3,下列有关说法正确的是

A.Al作负极B.C2O![]() 由负极迁移至正极
由负极迁移至正极
C.该装置将电能转变为化学能D.每生成1 mol Al2(C2O4)3,需要消耗134.4L的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭还原法也可以处理氮氧化物。向某密闭容器中加入足量的活性炭和一定量NO,发生反应C(s) + 2NO(g)![]() N2(g) + CO2(g) + Q(Q>0)。在T1℃时,反应进行到不同时间,测得容器内各物质的物质的量浓度如下:
N2(g) + CO2(g) + Q(Q>0)。在T1℃时,反应进行到不同时间,测得容器内各物质的物质的量浓度如下:
时间 /min | 0 | 10 | 20 | 30 | 40 | 50 | |
浓度 /mol·L-1 | NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 | |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 | |
①该反应的平衡常数表达式为________。0-10 min内NO的平均反应速率为____________。
②30 min后只改变某一条件,根据表中数据判断改变的条件可能是__________。相应地,平衡__(选填编号)。
a.向正反应方向移动 b.向逆反应方向移动 c.不发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验装置图回答(装置用代号表示)

①实验室制用高锰酸钾制氧气时,应选用的发生装置是_____;制氢气时应选用的发生装置是_____,制二氧化碳时应选用的发生装置是_____,检验二氧化碳气体可选用D装置,其装置中盛放的试剂一般是_______。
②用锌粒和浓盐酸反应制氢气,将制成的气体通入硝酸银,有白色沉淀,说明氢气中含有(写化学式)_____,反应方程式为______,若要制出纯净的氢气,除发生装置外还应选用的一种装置是_____;该装置中药品的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1) Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3) Fe(CO)5的熔点为-20 ℃,沸点为103 ℃,易溶于乙醚,其晶体类型为______,
(4) 科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为______________________。
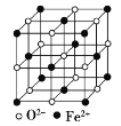
(5) FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρ g/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Cu原子的核外电子排布式为____________________
(2)从原子轨道重叠方式考虑,氮分子中的共价键类型有____________;
(3)![]() 水溶液中
水溶液中
①水分子中氧原子的杂化类型是_____,![]() 键键角____
键键角____![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]()
②不存在的微粒间作用力有______ 。
A.离子键 ![]() 极性键
极性键 ![]() 配位键
配位键 ![]() 氢键
氢键 ![]() 范德华力
范德华力
(4)黄铜矿冶炼铜时产生的![]() 可经过
可经过![]() 途径形成酸雨。
途径形成酸雨。
①![]() 的空间构型为________。从结构角度,解释
的空间构型为________。从结构角度,解释![]() 的酸性强于
的酸性强于![]() 的原因是_______
的原因是_______
②已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”
键”![]() 或大
或大![]() 键
键![]() 。大
。大![]() 键可用
键可用![]() 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大![]() 键的原子个数和电子数,如苯分子中大
键的原子个数和电子数,如苯分子中大![]() 键表示为
键表示为![]() 。下列微粒中存在“离域
。下列微粒中存在“离域![]() 键”的是_____;
键”的是_____;
A.![]() B.
B.![]() C.
C.![]()
③铜晶体中Cu原子的堆积方式如图①所示,其堆积方式为_____,配位数为_______.

④金铜合金的晶胞如图②所示。金铜合金具有储氢功能,储氢后Au原子位于顶点,Cu原子位于面心,H原子填充在由1个Au原子和距Au原子最近的3个Cu原子构成的四面体空隙中,若Cu原子与Au原子的最短距离为![]() ,阿伏加德罗常数的位为
,阿伏加德罗常数的位为![]() ,则该晶体储氢后密度为______
,则该晶体储氢后密度为______![]() 列出计算式
列出计算式![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com