
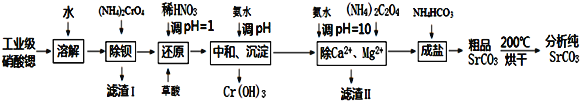
【题目】碳酸锶是重要的化工基础原料,由工业级硝酸锶(含有Ba2+、Ca2+、Mg2+等杂质)制备分析纯碳酸锶的工艺流程如下:
已知:①BaCrO4不溶于水,在水溶液中Cr2O72-与Ba2+不能结合。
②常温下,各物质的溶积常数如下表所示:
化合物 | Ca(OH)2 | CaC2O4 | Mg(OH)2 | MgC2O4 | Cr(OH)3 |
Ksp近似值 | 5.0×10-6 | 2.2×10-9 | 5.6×10-12 | 4.8×10-6 | 10-30 |
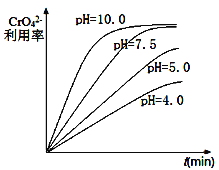
(1)“除钡”过程中CrO42-在不同pH时的利用率随时间变化曲线如下图所示,根据图像分析“除钡”过程中需要调节pH=7.5的原因_______________________________。
(2)“还原”过程中,应先调节pH=1.0,再加入草酸,加入草酸时发生反应的离子方程式为_____________________________。
(3)“滤渣Ⅱ”的主要成分为________________。
(4)“除Ca2+、Mg2+”后得到的滤液中除含有Sr(NO3)2外还含有过量的NH3·H2O,则“成盐”过程中发生反应的离子方程式为__________________________。
(5)“粗品SrCO3”烘干过程中除去的主要杂质为_____________________。
(6)在“中和、沉淀”步骤中,假定开始Cr3+,Zn3+浓度为0.1mol/L,调节至pH为_______时,铬开始沉淀;继续加碱调节至pH为_____时,铬刚好完全沉淀(离子浓度小于1×10-6mol/L时,即可认为该离子沉淀完全)。
【答案】pH过低CrO42-的利用率低,pH=7.5和pH=10时CrO42-的利用率相当,但后期需要将pH值调回1.0,导致浪费药品,因此应选用pH=7.5 8H++Cr2O72-+3H2C2O4=6CO2↑+2Cr3++7H2O CaC2O4和Mg(OH)2 NH3·H2O+HCO3-+Sr2+=SrCO3↓+NH4++H2O NH4NO3 4.3 6
【解析】
硝酸锶用水溶解,加入重铬酸铵除钡得到BaCr2O7沉淀,过滤分离,滤液中加入硝酸、草酸还原Cr2O72-,再加入氨水中和、沉淀得到Cr(OH)3,可知Cr2O72-被还原为Cr3+,草酸被氧化为二氧化碳,再过滤分离,滤液中加入氨水、醋酸铵、硫化氢,除去Ca2+、Mg2+、重金属,滤液中再加入碳酸氢铵得到碳酸锶,滤液中含有Sr2+,进行循环利用。
(1) pH过低 CrO42-的利用率低,pH=7.5和pH=10时CrO42-的利用率相当,但后期需要将pH调回1,导致浪费药品,因此应选用pH=7.5;
(2)步骤②是酸性条件下Cr2O72-被还原为Cr3+,草酸被氧化为二氧化碳,反应离子方程式为:3H2C2O4+8H++Cr2O72-=2Cr3++6CO2↑+7H2O,故答案为:3H2C2O4+8H++Cr2O72-=2Cr3++6CO2↑+7H2O;
(3)调pH为10是为了除去Ca2+和Mg2+,此时加入了草酸铵,由溶解度表可知MgC2O4的Ksp大于Mg(OH)2的Ksp,Ca(OH)2的Ksp大于CaC2O4,有沉淀转化关系可知,沉淀最终会转化成溶解度更小的沉淀,故“滤渣Ⅱ”的主要成分为CaC2O4和Mg(OH)2;
(4) NH3·H2O在溶液中发生电离,产生氢氧根离子,氢氧根离子和HCO3-反应生成CO32-,最终生成SrCO3沉淀,离子方程式为:NH3·H2O+HCO3-+Sr2+=SrCO3↓+NH4++H2O;
(5) 由于对产品的纯度要求是分析纯,而在成盐过程中生成的SrCO3经过滤和洗涤后,仍会含微量NH4NO3,因此需要在200 ℃时烘干使铵盐分解;
(6)起始n(Cr3+)=0.1mol/L,开始沉淀时Ksp= ![]() ,c(OH-)=
,c(OH-)= 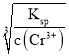 =
= ![]() =
= ![]() mol/L,pH=-lg
mol/L,pH=-lg 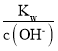 =-lg
=-lg ![]() =
= ![]() =4.3;当Cr3+除尽时,n(Cr3+)=10-6mol/L,此时c(OH-)=
=4.3;当Cr3+除尽时,n(Cr3+)=10-6mol/L,此时c(OH-)= 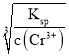 =
= ![]() =
= ![]() mol/L,pH=-lg
mol/L,pH=-lg 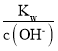 =-lg
=-lg ![]() =6。
=6。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) △H=-49.0 kJ·mol-1
2CH3OH(g)=CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
H2O(l)=H2O(g) △H= + 44 kJ·mol-1
则CO2与H2反应合成二甲醚生成液态水的热化学方程式为:____________________。
(2)工业上合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是___________
CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是___________
A.v正(H2) = 2v逆(CH3OH) B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变 E.容器的压强不变
(3)若反应2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如下表所示:
CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如下表所示:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度(mol·L-1) | 0.44 | 0.60 | 0.60 |
①比较该时刻正、逆反应速率的大小:v(正)_____v(逆)(填“>”、“<”或“=”)。
②若加入甲醇后,经10 min反应达到平衡,则平衡后c(CH3OH)=______________,
该时间内反应速率v(CH3OCH3)=_____________。
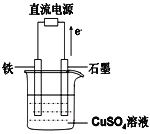
(4)利用二甲醚(CH3OCH3)设计一个燃料电池,用KOH溶液作电解质溶液,石墨做电极,该电池负极电极反应式为___________________________。以此燃料电池作为外接电源按如图所示电解硫酸铜溶液,如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入______其质量约为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、Q、W、R的原子序数与其常见化合价关系如图所示。下列说法正确的是
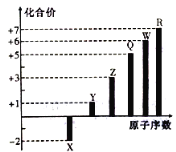
A.X、Y、Z、W、R的简单离子半径大小顺序为R>W>Z>Y>X
B.Q元素形成的可溶性盐的溶液不可能显酸性
C.X、Y、R形成的某种化合物可以用于漂白、消毒
D.Y、Z和W三者最高价氧化物对应的水化物间不能两两相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2012年11月某白酒企业生产的白酒被曝塑化剂超标267%,白酒产品中的塑化剂主要源于塑料接酒桶、塑料输酒管、成品酒塑料内盖等。塑化剂DEHP的合成线路如下:
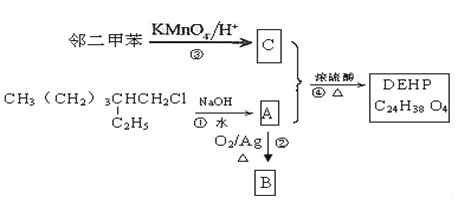
(1)A用系统命名法命名为______________,C分子核磁共振谱中显示有__________种不同化学环境的氢原子。C在一定条件下与乙二醇反应生成的高聚物是一种重要的合成纤维,俗称涤纶,其结构简式是__________。
(2)B含有的官能团名称为__________,①、②的反应类型分别为_______、_______。
(3)写出满足下列条件的C的同分异构体的结构简式:____________。
a.是苯的邻位二元取代物;b.遇FeCl3溶液显示特征颜色;
c.能与碳酸氢钠溶液反应
(4)写出下列反应的化学方程式:
反应②:_______________________________________________;
反应④:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是__(用离子方程式表示)。向该溶液中滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为__mol·L-1。(NH3·H2O的电离平衡常数为Kb=2×10-5)
(2)如图1是0.1mol/L电解质溶液的pH随温度变化的图像。
①其中符合0.1mol/LNH4Al(SO4)2溶液的pH随温度变化的曲线是__(填写字母),导致pH随温度变化的原因是__;
②20℃时,0.1mol/L的NH4Al(SO4)2溶液中2c(SO42-)-c(NH4+)-3c(Al3+)=___(填数值)。
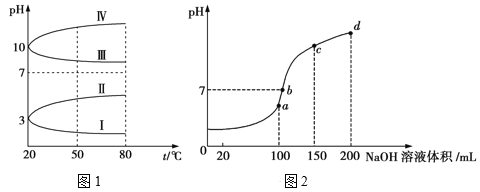
(3)室温时,向100mL0.1mol/L的NH4HSO4溶液中滴加0.1mol/LNaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是__;在b点,溶液中各离子浓度由大到小的排列顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答有关问题。
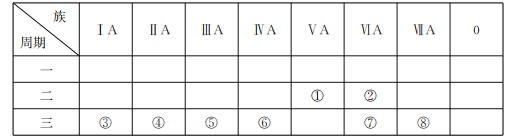
(1)写出元素符号:①___,⑥___。
(2)在这些元素中,最活泼的金属元素的原子结构示意图为___。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生反应的离子方程式为___。
(4)在②、③、④、⑤这些元素形成的最简单离子中,离子半径由大到小的顺序为___(填离子符号)。
(5)由元素②、③、⑧形成的一种常见的杀菌消毒剂中存在的化学键有___。
(6)由元素⑦和⑧形成的某种化合物可表示为X2Y2(其中各原子均满足8电子稳定结构),写出X2Y2的电子式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示。下列说法正确的是
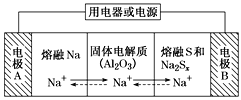
A.放电时,电极A为正极
B.充电时,Na+ 从电极A向电极B迁移
C.充电时,电极B反应式为S22-- 2e- === xS
D.该电池工作的适宜温度应控制在25 ℃左右
查看答案和解析>>
科目:高中化学 来源: 题型:
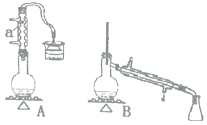
【题目】实验室用加热1一丁醇、浓H2SO4和溴化钠混合物的方法来制备1一溴丁烷,设计了如图所示的实验装置![]() 其中的夹持仪器已省略
其中的夹持仪器已省略![]() 。
。
已知:H2SO4+NaBr=NaHSO4+HBr, H2SO4(浓)+2HBr=Br2+SO2↑+2H2O
请回答下列问题:
(1)仪器a的名称为______。
(2)制备操作中,加入的浓硫酸事先要进行稀释,其目的是______![]() 填选项字母
填选项字母![]() 。
。
![]() 减少副产物烯和醚的生成
减少副产物烯和醚的生成![]() 减少
减少![]() 的生成
的生成![]() 水是反应的催化剂
水是反应的催化剂
(3)写出此实验制1一溴丁烷的总化学方程式______。
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“![]() ”,来确定副产物中是否存在丁醚
”,来确定副产物中是否存在丁醚![]() 请评价该同学设计的鉴定方案是否合理?理由是______。
请评价该同学设计的鉴定方案是否合理?理由是______。
(5)为了进一步提纯1一溴丁烷,该小组同学查得相关有机物的有关数据如表:
物质 | 熔点 | 沸点 |
1一丁醇 |
|
|
1一溴丁烷 |
|
|
丁醚 |
|
|
1一丁烯 |
|
|
则用B装置完成此提纯实验时;,实验中要迅速升高温度至______收集所得馏分。
(6)若实验中所取1一丁醇、NaBr分别为![]() 、
、![]() ,浓硫酸
,浓硫酸![]() ,蒸出的粗产物经洗涤,干燥后再次蒸馏得到
,蒸出的粗产物经洗涤,干燥后再次蒸馏得到![]() 一溴丁烷,则1一溴丁烷的产率是______
一溴丁烷,则1一溴丁烷的产率是______![]() 保留2位有效数字
保留2位有效数字![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子的杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A |
|
| 直线形 | 直线形 |
B |
|
| 平面三角形 | 三角锥形 |
C |
|
| 四面体形 | 平面三角形 |
D |
|
| 四面体形 | 正四面体形 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com