
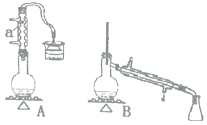
【题目】实验室用加热1一丁醇、浓H2SO4和溴化钠混合物的方法来制备1一溴丁烷,设计了如图所示的实验装置![]() 其中的夹持仪器已省略
其中的夹持仪器已省略![]() 。
。
已知:H2SO4+NaBr=NaHSO4+HBr, H2SO4(浓)+2HBr=Br2+SO2↑+2H2O
请回答下列问题:
(1)仪器a的名称为______。
(2)制备操作中,加入的浓硫酸事先要进行稀释,其目的是______![]() 填选项字母
填选项字母![]() 。
。
![]() 减少副产物烯和醚的生成
减少副产物烯和醚的生成![]() 减少
减少![]() 的生成
的生成![]() 水是反应的催化剂
水是反应的催化剂
(3)写出此实验制1一溴丁烷的总化学方程式______。
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“![]() ”,来确定副产物中是否存在丁醚
”,来确定副产物中是否存在丁醚![]() 请评价该同学设计的鉴定方案是否合理?理由是______。
请评价该同学设计的鉴定方案是否合理?理由是______。
(5)为了进一步提纯1一溴丁烷,该小组同学查得相关有机物的有关数据如表:
物质 | 熔点 | 沸点 |
1一丁醇 |
|
|
1一溴丁烷 |
|
|
丁醚 |
|
|
1一丁烯 |
|
|
则用B装置完成此提纯实验时;,实验中要迅速升高温度至______收集所得馏分。
(6)若实验中所取1一丁醇、NaBr分别为![]() 、
、![]() ,浓硫酸
,浓硫酸![]() ,蒸出的粗产物经洗涤,干燥后再次蒸馏得到
,蒸出的粗产物经洗涤,干燥后再次蒸馏得到![]() 一溴丁烷,则1一溴丁烷的产率是______
一溴丁烷,则1一溴丁烷的产率是______![]() 保留2位有效数字
保留2位有效数字![]() 。
。
【答案】球形冷凝管 ab CH3CH2CH2CH2OH+NaBr+H2SO4![]() CH3CH2CH2CH2Br+NaHSO4+H2O 不合理,因为产物
CH3CH2CH2CH2Br+NaHSO4+H2O 不合理,因为产物![]() 溴丁烷也含有
溴丁烷也含有![]()
![]()
![]()
【解析】
(1)仪器a的名称为球形冷凝管,故答案为:球形冷凝管;
(2)1—丁醇在浓硫酸的催化作用下发生分子内脱水制取丁烯,分子间脱水得到醚,发生分子间脱水形成醚![]() ,分子内脱水生成正丁烯
,分子内脱水生成正丁烯![]() ,同时有溴离子被浓硫酸氧化成溴单质,故答案为:ab;
,同时有溴离子被浓硫酸氧化成溴单质,故答案为:ab;
(3)浓![]() 和溴化钠先生成HBr,在酸性条件下HBr与
和溴化钠先生成HBr,在酸性条件下HBr与![]() 丁醇发生取代反应生成
丁醇发生取代反应生成![]() 溴丁烷,反应的温度不可过高,否则有溴生成,反应的化学方程式为CH3CH2CH2CH2OH+NaBr+H2SO4
溴丁烷,反应的温度不可过高,否则有溴生成,反应的化学方程式为CH3CH2CH2CH2OH+NaBr+H2SO4![]() CH3CH2CH2CH2Br+NaHSO4+H2O ,故答案为:CH3CH2CH2CH2OH+NaBr+H2SO4
CH3CH2CH2CH2Br+NaHSO4+H2O ,故答案为:CH3CH2CH2CH2OH+NaBr+H2SO4![]() CH3CH2CH2CH2Br+NaHSO4+H2O;
CH3CH2CH2CH2Br+NaHSO4+H2O;
(4)红外光谱仪利用物质对不同波长的红外辐射的吸收特性,进行分子结构和化学组成分析,产物![]() 也含有
也含有![]() ,所以不能通过红外光谱仪来确定副产物中是否存在丁醚
,所以不能通过红外光谱仪来确定副产物中是否存在丁醚![]() ,故答案为:不合理,产物
,故答案为:不合理,产物![]() 溴丁烷也含有
溴丁烷也含有![]() ;
;
(5)提纯![]() 溴丁烷,收集所得馏分为
溴丁烷,收集所得馏分为![]() 溴丁烷,所以须将
溴丁烷,所以须将![]() 溴丁烷先汽化,后液化,汽化须温度达其沸点,故答案为:
溴丁烷先汽化,后液化,汽化须温度达其沸点,故答案为:![]() ;
;
(6)7.4g1—丁醇完全反应需要NaBr的质量为![]() ,故丁醇不足,则理论上得到
,故丁醇不足,则理论上得到![]() 溴丁烷质量为
溴丁烷质量为![]() ,实际得到
,实际得到![]() 溴丁烷,故其产率
溴丁烷,故其产率![]() ,故答案为:
,故答案为:![]() 。
。


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
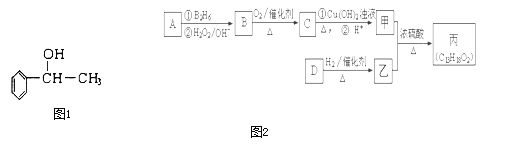
【题目】苏合香醇可以用作食用香精,其结构简式如图1所示.
已知:R-CH=CH2 ![]() R-CH2CH2OH
R-CH2CH2OH
![]() 一
一![]() 苏合香醇的分子式为 ______ ,它不能发生的有机反应类型有
苏合香醇的分子式为 ______ ,它不能发生的有机反应类型有![]() 填数字序号
填数字序号![]() ______ .
______ .
![]() 取代反应
取代反应![]() 加成反应
加成反应![]() 消去反应
消去反应![]() 加聚反应
加聚反应![]() 氧化反应
氧化反应![]() 水解反应,
水解反应,
![]() 二
二![]() 有机物丙是一种香料,其合成路线如图
有机物丙是一种香料,其合成路线如图![]() 其中甲的相对分子质量通过质谱法测得为88,它的核磁共振氢谱显示只有三组峰;乙与苏合香醇互为同系物.
其中甲的相对分子质量通过质谱法测得为88,它的核磁共振氢谱显示只有三组峰;乙与苏合香醇互为同系物.
![]() 按照系统命名法,A的名称是 ______ .
按照系统命名法,A的名称是 ______ .
![]() 与新制
与新制![]() 悬浊液反应的化学方程式为 ______ .
悬浊液反应的化学方程式为 ______ .
![]() 丙中含有两个
丙中含有两个![]() ,D可发生银镜反应,在催化剂存在下1molD与2mol
,D可发生银镜反应,在催化剂存在下1molD与2mol![]() 可以反应生成乙,则D的结构简式为 ______ .
可以反应生成乙,则D的结构简式为 ______ .
![]() 甲与乙反应的化学方程式为 ______ .
甲与乙反应的化学方程式为 ______ .
![]() 苯环上有3个取代基或官能团,且显弱酸性的乙的同分异构体共有 _____ 种,其中3个取代基或官能团互不相邻的有机物结构简式为 ______ .
苯环上有3个取代基或官能团,且显弱酸性的乙的同分异构体共有 _____ 种,其中3个取代基或官能团互不相邻的有机物结构简式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锶是重要的化工基础原料,由工业级硝酸锶(含有Ba2+、Ca2+、Mg2+等杂质)制备分析纯碳酸锶的工艺流程如下:
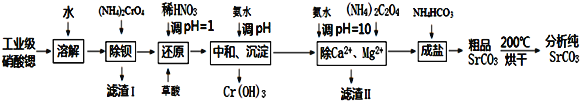
已知:①BaCrO4不溶于水,在水溶液中Cr2O72-与Ba2+不能结合。
②常温下,各物质的溶积常数如下表所示:
化合物 | Ca(OH)2 | CaC2O4 | Mg(OH)2 | MgC2O4 | Cr(OH)3 |
Ksp近似值 | 5.0×10-6 | 2.2×10-9 | 5.6×10-12 | 4.8×10-6 | 10-30 |
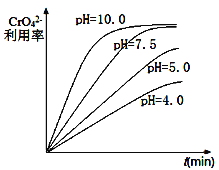
(1)“除钡”过程中CrO42-在不同pH时的利用率随时间变化曲线如下图所示,根据图像分析“除钡”过程中需要调节pH=7.5的原因_______________________________。
(2)“还原”过程中,应先调节pH=1.0,再加入草酸,加入草酸时发生反应的离子方程式为_____________________________。
(3)“滤渣Ⅱ”的主要成分为________________。
(4)“除Ca2+、Mg2+”后得到的滤液中除含有Sr(NO3)2外还含有过量的NH3·H2O,则“成盐”过程中发生反应的离子方程式为__________________________。
(5)“粗品SrCO3”烘干过程中除去的主要杂质为_____________________。
(6)在“中和、沉淀”步骤中,假定开始Cr3+,Zn3+浓度为0.1mol/L,调节至pH为_______时,铬开始沉淀;继续加碱调节至pH为_____时,铬刚好完全沉淀(离子浓度小于1×10-6mol/L时,即可认为该离子沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向一定浓度的Na2X溶液中滴入盐酸,溶液的pH与离子浓度变化关系如图所示。

已知:H2X是二元弱酸,Y表示![]() 或
或![]() ,pY=﹣lgY.下列叙述不正确的是( )
,pY=﹣lgY.下列叙述不正确的是( )
A. 曲线n表示pH与p![]() 的变化关系
的变化关系
B. Ka2(H2X)=1.0×10﹣10.3
C. NaHX溶液中c(H+)>c(OH﹣)
D. 当溶液呈中性时,c(Na+)=c(HX﹣)+2c(X2﹣)+c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下把V体积氨气溶于1体积水中得到氨的饱和溶液,试完成下列填空。
(1)NH3通入水中发生的反应为____________________。
(2)氨水中存在的分子有__________________________。
(3)氨水中存在的离子有__________________________。
(4)所得氨水的质量分数为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的有害气体主要有NO、碳氢化合物及CO,某校同学设计实验将模拟汽车尾气转化为无害气体。回答下列问题;
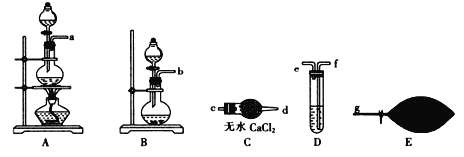
(1) 为了配制模拟尾气,甲组同学用上图所示装置分别制备NO、乙烯及CO三袋气体。
① 在实验室中用装置A制取NO,分液漏斗中盛放的是_______(填试剂名称)。
② 用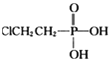 (乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为(已知磷转化为Na3 PO4)_______________________。
(乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为(已知磷转化为Na3 PO4)_______________________。
③ 用H2C2O4与浓硫酸制取CO的化学方程式:H2C2O4 ![]() CO↑ + CO2 ↑+ H2O↑,然后进行提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为(气流从左至右)___________→g,其中装置C中主要仪器的名称是________,装置D中盛放的药品是_______。
CO↑ + CO2 ↑+ H2O↑,然后进行提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为(气流从左至右)___________→g,其中装置C中主要仪器的名称是________,装置D中盛放的药品是_______。
(2) 乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气(NO、CO、C2 H4及空气),按如图所示装置进行尾气转化并检验。
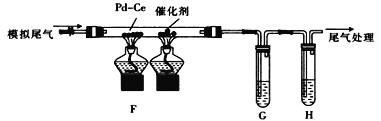
① 为检验催化反应后的气体中是否有CO2生成和乙烯的残留,G、H中盛放的试剂依次是_______(填标号)。
a. NaOH溶液 b. 酸性KMnO4溶液 c. 澄清石灰水 d. Br2/CCl4溶液
② 通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是__________________;写出其中CO与NO完全转化为无害气体的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家发现,在常温常压与可见光照射下,N2与H2O在水滑石(LDH)表面发生反应:2N2(g) + 6H2O(g) ![]() 4NH3(g) + 3O2(g) – Q(Q>0)。关于该过程的说法错误的是
4NH3(g) + 3O2(g) – Q(Q>0)。关于该过程的说法错误的是
A.属于固氮过程
B.太阳能转化为化学能
C.反应物的总能量高于生成物的总能量
D.反应物的总键能高于生成物的总键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志。根据下面转化关系回答问题。

(1)分别写出A和E中官能团的名称:A中_________;E中_________;
(2)操作⑥的名称为________________。
(3)写出反应类型:④_________;
(4)请写出下列反应的化学方程式:
①写出A和B在浓硫酸中加热反应的方程式_________________;
②B在金属铜存在下在空气中加热反应________________;
(5)F是一种常见的高分子材料,它给我们带来了巨大的方便。然而,这种材料造成的当今的某一环境问题是__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1) Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3) Fe(CO)5的熔点为-20 ℃,沸点为103 ℃,易溶于乙醚,其晶体类型为______,
(4) 科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为______________________。
(5) FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρ g/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。
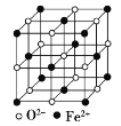
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com