
【题目】氢氧化铁胶体制备步骤如下:
①用烧杯取少量蒸馏水,放在酒精灯上加热至沸腾;
②向烧杯中逐滴加入饱和FeCl3溶液;
③继续煮沸至液体是透明的红褐色,即得Fe(OH)3胶体.
回答下列问题:
(1)写出制备Fe(OH)3胶体的化学方程式;
(2)如何确定你制备胶体是否成功?;
(3)若向Fe(OH)3胶体中逐滴加入H2SO4溶液至过量会出现的现象: .
【答案】
(1)FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
(2)出现丁达尔效应说明胶体制备成功
(3)先出现红褐色沉淀,随后沉淀溶解
【解析】解:(1)制备Fe(OH)3胶体是利用了Fe3+在溶液中结合了水中的OH﹣ , 生成了Fe(OH)3(胶体)和HCl,化学方程式为:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl,故答案为:FeCl3+3H2O
Fe(OH)3(胶体)+3HCl,故答案为:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl;(2)胶体区别于其他分散系的特有的性质为丁达尔效应,故要判断胶体是否制备成功,可以用丁达尔效应来判断,当可见光通过时出现一条光亮的通路,
Fe(OH)3(胶体)+3HCl;(2)胶体区别于其他分散系的特有的性质为丁达尔效应,故要判断胶体是否制备成功,可以用丁达尔效应来判断,当可见光通过时出现一条光亮的通路,
故答案为:出现丁达尔效应说明胶体制备成功;(3)向Fe(OH)3胶体中逐滴加入H2SO4溶液至过量,电解质H2SO4电离出的SO42﹣使Fe(OH)3胶体发生聚沉,生成红褐色沉淀,氢氧化铁胶体聚沉后会产生氢氧化铁沉淀,继续加入硫酸,会发生酸碱中和反应,生成氯化铁和水,此反应的离子方程式是Fe(OH)3+3H+═Fe3++3H2O,出现的现象为:先出现红褐色沉淀,随后沉淀溶解,
故答案为:先出现红褐色沉淀,随后沉淀溶解.
(1)制备Fe(OH)3胶体是利用了Fe3+在溶液中的水解;(2)根据胶体的独有的性质﹣﹣丁达尔效应来分析;(3)根据胶体的性质判断,加入稀硫酸产生聚沉现象;氢氧化铁胶体聚沉后会产生氢氧化铁沉淀,硫酸和氢氧化铁沉淀反应,生成硫酸铁和水.


科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下).有机物A的实验式为;
(2)质谱仪测定有机化合物A的相对分子质量为46,A的核磁共振氢谱如图所示,则A的结构简式为; 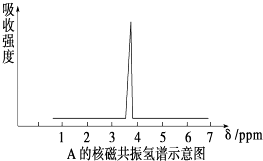
(3)A的同分异构体B属于醇,则23g B 与足量的金属钠反应产生的气体在在标准状况下的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备硅单质时,主要化学反应如下:
(1)SiO2+2C ![]() Si(粗硅)+2CO
Si(粗硅)+2CO
(2)Si(粗)+2Cl2 ![]() SiCl4
SiCl4
(3)SiCl4+2H2 ![]() Si (纯)+4HCl
Si (纯)+4HCl
对上述三个反应叙述中,不正确的是( )
A.(1)(3)为置换反应
B.(1)(2)(3)均为氧化还原反应
C.(2)为化合反应
D.反应物中硅元素均被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列所示实验装置制取乙酸乙酯.回答以下问题: 
(1)在大试管中先加入3mL , 然后一边摇动一边慢慢地加入2mL和2mL乙酸,混合均匀,然后加入几粒碎瓷片.按上图连好装置,用酒精灯对大试管小心均匀加热.当观察到明显现象时停止实验.
(2)与书中采用的实验装置的不同之处是:这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中.在此处球形干燥管的作用除了使乙酸乙醋充分冷凝外还有;
(3)有甲、乙、丙三位同学,分别将乙酸与乙醉反应得到的酯(未用饱和Na2CO3溶液承接)提纯,在未用指示剂的情况下,他们都是先加NaOH中和过量的酸,然后用蒸馏法将酯分离出来.但他们的结果却不同: ①甲得到了不溶于水的中性酯;②乙得到显酸性的酯的混合物;③丙得到大量水溶性物质.
试判断三位同学加入的NaOH是多了还是怡好还是少了(填“少量”、“适量”、“过量“)
①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将在空气中暴露一段时间后的氢氧化钠固体样本溶于水得溶液A,将所得溶液中逐滴滴加稀硫酸至过量,生成的二氧化碳体积(标准状况下)与加入稀硫酸体积关系如图所示.

已知:在碳酸钠溶液中逐滴加入稀硫酸反应按以下步骤进行:
①CO32-+H+═HCO3- ②H++HCO3-═CO2↑+H2
试计算:
(1)溶液A中滴加硫酸的体积在0-150mL间无CO2气体生成的原因是(用离子方程式表示)______.
(2)硫酸滴加至150mL时,此时溶液中溶质主要成分为(写化学式)______.
(3)溶液A中碳酸钠的质量为______g.
(4)硫酸的物质的量浓度为______mol/L.
(5)该样品中Na2CO3与NaOH物质的量之比为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能减慢化学反应速率的是( )
A.用Zn和2molL﹣1H2SO4反应制取H2时,向溶液中滴加少量CuSO4溶液
B.日常生活中,将食物贮藏在冰箱中
C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末
D.用相同质量的锌粉替代锌粒与同浓度、同体积的盐酸反应制氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型,据此回答下列问题:
(1)同物质的量的A、B、C、D燃烧,耗氧量最大的是(填对应字母); 同质量的A、B、C、D燃烧,耗氧量最大的是(填对应字母);
(2)所有原子都在同一平面上的是(填对应字母);
(3)能使酸性高锰酸钾褪色的是(填对应字母);
(4)写出C发生聚合反应的化学方程式;
(5)写出实验室制取D的化学方程式;
(6)写出G和硝酸反应的化学方程式 . 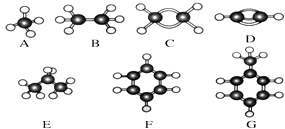
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如表:
按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/gcm﹣3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了气体.继续滴加至液溴滴完.装置d的作用是
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是(填入正确选项前的字母);
A.重结晶
B.过滤
C.蒸馏
D.萃取
(4)在该实验中,a的容积最适合的是(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL
(5)写出a中反应的主要有机化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com