
【题目】设NA为阿伏加德罗常数的值。下列说法中正确的是
A.28 g乙烯所含的共用电子对数目为2NA
B.133.5 g AlCl3晶体含有的粒子数目为4NA
C.0.1 mol Cl2与足量石灰乳反应,转移电子的数目为0.2NA
D.将0.2 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH![]() 的数目为0.2NA
的数目为0.2NA
【答案】D
【解析】
A. 1个乙烯分子含有6对共用电子对,28 g乙烯的物质的量为1 mol,则所含的共用电子对数目为6NA,故A错误;
B. 粒子指代不明,无法确定个数,故B错误;
C. Cl2与足量石灰乳反应生成氯化钙、次氯酸钙,所以0.1 mol Cl2与足量石灰乳反应,转移电子的数目为0.1NA,故C错误;
D. 将0.2 mol NH4NO3溶于稀氨水,根据电荷守恒可知:N(NH4+)+N(H+)=N(NO3-)+N(OH-),溶液呈中性,即N(H+)=N(OH-),则N(NH4+)=N(NO3-)=0.2 mol ,故溶液中NH4+的数目为0.2NA,故D正确。
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】由碳酸锰矿(主要成分MnCO3,还含有FeCO3、MnO2、Al2O3、SiO2等)中提取金属锰的一种流程如下:

(1) “酸浸”过程中,提高锰元素浸出率的措施有:适当提高酸的浓度、________________(填一种)。
(2) 保持其他条件不变,在不同温度下对碳酸锰矿进行酸浸,锰元素的浸出率随时间变化如下图所示,则酸浸的最佳温度和时间分别是________。

提取过程中相关金属离子生成氢氧化物沉淀的pH
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.8 |
(3) 已知“酸浸”后溶液中锰元素只以Mn2+形式存在,则“酸浸”中发生氧化还原反应的离子方程式为________________________________________。
(4) 结合上表,“除铁、铝”时加入氨水控制反应液pH的范围为________。
(5) 若上述流程中加入的H2O2不足量,则待电解溶液中会有铁元素残余,进而会影响最终锰的纯度。请设计简要实验方案加以验证待电解溶液中是否含有铁元素: _________________。
(6) 以石墨为电极电解除铁、铝后的溶液获得单质锰。电解废液中可循环利用的溶质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究物质的结构有助于对物质的性质进行研究。
(1)① 下列物质中含有羧基的是____(填字母)。
a ![]() b
b ![]() c
c 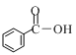
② 下列物质分子中所有原子处于同一平面的是____(填字母)。
a 苯 b 丙烯 c 甲醇
③ 欲区分乙醛和乙酸,应选用____(填字母)。
a NaOH溶液 b HCl溶液 c NaHCO3溶液
(2)书写化学方程式并写出反应类型:
①甲烷与氯气在光照条件下的反应(写第一步:)__________ ,属于________反应
②乙烯使溴水或溴的四氯化碳溶液褪色:___________,属于________反应
③灼热的铜丝多次反复地插入乙醇中:____________,属于_______反应;
(3)已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
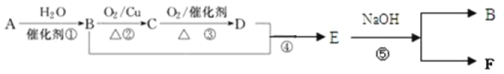
①:B分子中官能团的名称是________,D中官能团的名称是_____________;反应①的反应类型是___________反应。
②:反应⑤的化学方程式是_____________。
(4)①某同学用如图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。上述实验中试管甲中试剂为________,其作用是________(填字母)。
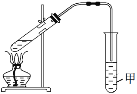
A 中和乙酸和乙醇
B 中和乙酸并吸收部分乙醇
C 乙酸乙酯在无机盐溶液中的溶解度比在水中更小,有利于分层析出
D 加速酯的生成,提高其产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol H—H键的键能是436kJ,1 mol I—I键的键能是151kJ,1 mol H—I键的键能是299kJ,则对反应H2(g)+I2(g)![]() 2HI(g)的说法,不正确的是 ( )
2HI(g)的说法,不正确的是 ( )
A.放热反应B.吸热反应C.化合反应D.可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是__________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阳极区与生成的氯气反应产生少量NCl3,该反应的化学方程式为_____________。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | n (CO2)/mol | V (NaOH) /L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件CO2与NaOH 溶液反应生成NaHCO3的热化学反应方程式为______________________。
(3)利用CO可以将NO转化为无害的N2,其反应为: 2NO(g) +2CO(g) ![]() N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
N甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
N乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
/p>
①甲容器中,0~40min 内用NO的浓度变化表示的反应速率v(NO)=_____________。
②该反应的△H____0(填“>”或“<”)。
③甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______(填“正向”、“逆向”或“不”)移动。
(4)常温下, 在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O![]() NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
(5)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如下图所示
①太阳能电池的负极是__________(填“a”或“b”)
②生成丙烯的电极反应式是_____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g46%甲酸(HCOOH)水溶液所含的氧原子数为5NA
B. 标准状况下,18g冰水中共价键的数目为NA
C. 56g铁与71gCl2充分反应,转移电子数目为3NA
D. 7.8gNa2O2与足量的水(H218O)反应生成的氧气所含的中子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。已知:在无氧条件下,葡萄糖发生反应C6H12O6![]() 2CH3CH2OH+2CO2↑。下列说法正确的是( )
2CH3CH2OH+2CO2↑。下列说法正确的是( )
A. 0.1 mol葡萄糖(C6H12O6)含羟基(—OH)数目为0.6NA
B. 10.0 g质量分数为46%的酒精与足量的钠反应产生氢分子数为0.05NA
C. 常温常压下,4.48 L CO2和NO2的混合气体含原子总数为0.6NA
D. 4.8 g Mg在足量的CO2中完全燃烧,转移电子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中常以草酸钠![]() 为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化学方程式为:
为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化学方程式为:![]() 下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是( )
下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是( )
A.滴定过程中,高锰酸钾被氧化,草酸钠被还原
B.用碱式滴定管量取高锰酸钾溶液
C.该反应中,消耗的草酸钠与高锰酸钾的物质的量之比为5:2
D.为便于滴定终点的判断,滴定时必须往体系中加入指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在25 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1CH3COOH溶液,pH与滴加CH3COOH溶液体积的关系曲线如下图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )
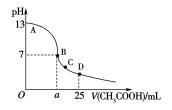
A. 在A、B间任一点,溶液中一定都c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B. 在B点:a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C. 在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. 在D点:c(CH3COO-)+c(CH3COOH)=0.1mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com