
下列说法正确的是
①11H、21H、31H为三种不同的核素 ②11H、21H、31H互为同位素
③11H、21H、31H互为同素异形体 ④11H、21H、31H同系物 ⑤11H、21H、31H同分异构体
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置
⑦互为同位素的原子性质相同
| A.①②⑥ | B.①②③⑥ | C.①②⑥⑦ | D.①②③⑥⑦ |
A
解析试题分析:①11H、21H、31H中质子数相同,中子数不同,为三种不同的核素,正确;②11H、21H、31H中质子数相同,中子数不同,互为同位素,正确;③11H、21H、31H互为同位素,不是同素异形体,由同一种元素形成形成的不同单质互为同素异形体,错误;④结构相似,分子组成相差若干个CH2原子团的有机物互为同系物,11H、21H、31H互为同位素,错误;⑤分子式相同而结构不同的化合物互为同分异构体,11H、21H、31H互为同位素,错误;⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置,正确;⑦互为同位素的原子化学性质相同,物理性质不同,错误,答案选A。
考点:考查同位素、同素异形体、同系物和同分异构体的判断


科目:高中化学 来源: 题型:填空题
按要求填空:
(1)除去NaHCO3溶液中的少量Na2CO3,方法是: 。
(2)呼吸面具中所用的药品是 ;反应的化学方程式为: 。
(3)由铝盐制取氢氧化铝,所用的试剂为 ;离子方程式为: 。
(4)写出硅酸钠溶液在空气中变质的化学方程式: 。
(5)写出用熟石灰吸收氯气制漂白粉的化学方程式: 。
(6)将CaMg3Si4O12改写为氧化物的形式:______________________________________________。
(7)写出实验室制取氯气的化学方程式_____________________________。反应转移电子总数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为
电解后的溶液PH 7(填大于、小于、等于);其原因是 (用离子方程式表示)
(2)KAl(SO4)2溶液中质子守恒等式为
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。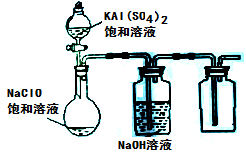
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。此时反应的离子方程式为
。
②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体。写出在光照射下混合液中反应的化学方程式是 。
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4·FeSO4)溶液,其他不变。打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液。观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生。此时烧瓶中发生的氧化还原反应的离子方程式为
。
(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为 (忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
abcd是四种短周期元素。a、b、d同周期,c、d同主族.a原子结构示意图 ,b与c形成化合物的电子式为如图
,b与c形成化合物的电子式为如图 。下列比较中正确的是
。下列比较中正确的是
| A.原子半径:a >c>d | B.非金属性:a >b>d |
| C.单质的熔点:c> a | D.最高价氧化物对应的水化物的酸性:c>d>a |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子的“未成对电子”的说法,错误的是( )
①奇数族元素的基态原子,其原子轨道中一定含有“未成对电子”
②偶数族元素的基态原子,其原子轨道中一定不含“未成对电子”
③偶数族元素的基态原子,其原子轨道中可能含有“未成对电子”
④奇数族元素的基态原子,其原子轨道中可能不含“未成对电子”
| A.①③ | B.②④ | C.② | D.④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
| A.X的氢化物溶于水显酸性 | B.Y的氧化物是共价化合物 |
| C.其离子半径大小: Z>Y>X | D.X和Z的最高价氧化物对应的水化物都是强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com