
按要求填空:
(1)除去NaHCO3溶液中的少量Na2CO3,方法是: 。
(2)呼吸面具中所用的药品是 ;反应的化学方程式为: 。
(3)由铝盐制取氢氧化铝,所用的试剂为 ;离子方程式为: 。
(4)写出硅酸钠溶液在空气中变质的化学方程式: 。
(5)写出用熟石灰吸收氯气制漂白粉的化学方程式: 。
(6)将CaMg3Si4O12改写为氧化物的形式:______________________________________________。
(7)写出实验室制取氯气的化学方程式_____________________________。反应转移电子总数为____。
(1)通入足量的CO2(2)过氧化钠;2Na2O2+2CO2=2Na2CO3+O2
(3)氨水和可溶性铝盐(或氨气和硫酸铝或氯化铝);Al3++3NH3·H2O=3NH4++Al(OH)3↓
(4)Na2SiO3+CO2+H2O=H2SiO3(胶体)+Na2CO3(沉淀也可以)
(5)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O (6)CaO·3MgO·4SiO2
(7)MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑ 2e-
MnCl2+2H2O+Cl2↑ 2e-
解析试题分析:(1)碳酸钠能吸收CO2生成碳酸氢钠,因此除去NaHCO3溶液中的少量Na2CO3的方法是通入足量的CO2。
(2)过氧化钠可以作为供氧剂,因此呼吸面具中所用的药品是过氧化钠,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。
(3)由于氢氧化铝是两性氢氧化物,能溶于酸或强碱中,因此由铝盐制取氢氧化铝,所用的试剂为氨水和可溶性铝盐,反应的离子方程式为Al3++3NH3·H2O=3NH4++Al(OH)3↓。
(4)碳酸的酸性强于硅酸的酸性,因此硅酸钠能吸收CO2生成硅酸而变质,则硅酸钠溶液在空气中变质的化学方程式为Na2SiO3+CO2+H2O=H2SiO3(胶体)+Na2CO3(沉淀也可以)。
(5)氯气能和碱液反应用来制备漂白粉或漂白液,因此用熟石灰吸收氯气制漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(6)硅酸盐改写成氧化物形式的方法技巧为氧化物的顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水;氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置系数;氧化物之间以“·”隔开;系数配置出现分数应化为整数。则将CaMg3Si4O12改写为氧化物的形式为CaO·3MgO·4SiO2。
(7)实验室用二氧化锰氧化浓盐酸制取氯气,因此反应的化学方程式为MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑。其中Mn元素的化合价从+4价降低到+2价,得到2个电子,所以反应中转移电子的个数是2e-。
MnCl2+2H2O+Cl2↑。其中Mn元素的化合价从+4价降低到+2价,得到2个电子,所以反应中转移电子的个数是2e-。
考点:考查物质的除杂、过氧化钠、氯气的用途、氢氧化铝和氯气的制备、硅酸盐的表示和性质、以及氧化还原反应的计算


科目:高中化学 来源: 题型:单选题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥NH3 |
| B | SO2有漂白性 | SO2可使溴水的橙色褪去 |
| C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| D | 锌金属性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
新型无机非金属材料甲和乙均是高温陶瓷材料,硬度大、熔点高、化学性质稳定。甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成。甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g·L-1,在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解。Z元素的氧化物是制造光导纤维的主要材料,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙。请回答下列问题:
(1)乙的化学式为__________;丙的电子式为__________。
(2)甲与NaOH浓溶液共热的化学方程式为__________________________________________。
(3)丁溶液中通入少量CO2的离子方程式为________________________________________。
(4)高温条件下,丙与Fe2O3反应生成Fe和X单质,写出该反应的化学方程式为____________________,有人提出生成的产物Fe中可能还有FeO,请设计实验方案验证之(用化学方法)____________________。
(5)工业上在X单质的气氛下将Z的氧化物和焦炭加热到1400℃~1450℃的条件下以制备乙,反应中还生成一种常见的可燃性气体戊,该反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。
(1)某研究小组设计SnSO4制备路线如下: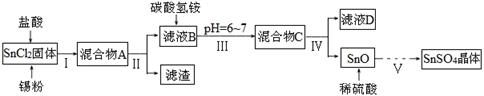
已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
①SnCl2酸溶后加入Sn粉的作用是 。
②步骤Ⅱ中用到的玻璃仪器除烧杯外还有 ;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为 。
③步骤Ⅴ涉及到的操作有:a.过滤 b.洗涤 c.蒸发浓缩 d.冷却结晶 e.低温干燥,则其正确的操作顺序为 。
(2)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。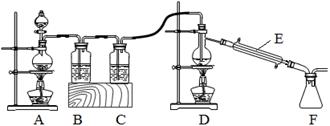
①装置C中应加入试剂为___________;仪器E的名称为____________________。
②反应开始生成SnCl4时,可以先熄灭___(填字母序号)处的酒精灯,理由是________。
③该实验装置设计尚存在缺陷,改进的方法是(包括仪器、试剂及连接位置等)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.A、B、C、D均是前四周期元素组成的常见不同单质或化合物。它们之间有如下转化关系:
(1)若A、B、C、D都是氧化物,且A为光导纤维的主要材料,试写出③化学反应方程式: _______ __________
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是________ _______, C盐水溶液PH______7 (填“>”“<”“ =”)。
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是______(填“小写”字母)。
a.A可能是一种耐火材料;
b.B的溶液一定呈碱性;
c.C 一定既溶于盐酸又溶于苛性钠溶液;
若A为金属单质,则用1molA金属制备C,最少需_____mol HCl和_____mol NaOH。
Ⅱ.汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅含有Na、Fe、N、O四种元素。水溶性实验表明,固体粉末部分溶解。经检测,可溶物为化合物甲,不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲(摩尔质量为65g/ mol),加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成一种碱性氧化物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲受热分解的化学方程式为 。
(2)丙的电子式为 。
(3)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 。
A.KCl B.KOH C.Na2S D.CuO
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
完成下列填空
(1)向煤中加入适量的 ,可以大大减少燃烧产物中SO2的量。
(2)铝制品具有良好抗腐蚀性的原因是 。
(3)在少量的胆矾晶体中加入3 mL浓硫酸,片刻后变白色,证明浓硫酸具有 性。
(4)区别氯化铁溶液与氢氧化铁胶体的实验名称是 实验。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、
Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有________,看到的现象是 ________,反应的方程式为___________________________
(2)实验室制取氯气的化学方程式: 括号中为杂质,填上除杂试剂:Cl2中(HCl) 。
(3)由SiO2制取粗硅的化学方程式
(4)将ag由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为 ag (> ;< ;=)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
五种元素原子半径最大是(写元素符号)
X与Z形成的化合物中,既含极性键又含非极性键的是(写分子式)————
由以上某些元素组成的化合物A、B、C、D有如下转化关系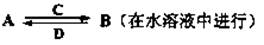
①其中C是溶于水显酸性的气体;D是淡黄色固体。写出C与D反应的化学方程式
②如果A由四种元素组成、B均由三种元素组成,B为两性不溶物,则A为(填名称)
由A与过量C反应转化为B的离子方程式
③如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。则B为(填化学式) 。A、B浓度均为0.1mol/L的混合溶液,碱性较强的是(填溶液名称)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
①11H、21H、31H为三种不同的核素 ②11H、21H、31H互为同位素
③11H、21H、31H互为同素异形体 ④11H、21H、31H同系物 ⑤11H、21H、31H同分异构体
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置
⑦互为同位素的原子性质相同
| A.①②⑥ | B.①②③⑥ | C.①②⑥⑦ | D.①②③⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com