
人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子的“未成对电子”的说法,错误的是( )
①奇数族元素的基态原子,其原子轨道中一定含有“未成对电子”
②偶数族元素的基态原子,其原子轨道中一定不含“未成对电子”
③偶数族元素的基态原子,其原子轨道中可能含有“未成对电子”
④奇数族元素的基态原子,其原子轨道中可能不含“未成对电子”
| A.①③ | B.②④ | C.② | D.④ |
B
解析试题分析: ①核外电子数为奇数的基态原子,则原子最外层电子数为奇数,若最外层为nsx,则x=1,含有未成对电子;若最外层为ns2npy,则y=1或3或5,np轨道一定含有未成对电子,故A正确;
④、核外电子数为偶数的基态原子,则原子最外层电子数为奇数,若最外层为nsx,则x=2,不含有未成对电子;若最外层为ns2npy,则y=2或4,np轨道一定含有未成对电子,故B错误;
③、核外电子数为偶数的基态原子,则原子最外层电子数为奇数,若最外层为nsx,则x=2,不含有未成对电子;若最外层为ns2npy,则y=2或4,np轨道一定含有未成对电子,故C正确;
④、核外电子数为奇数的基态原子,则原子最外层电子数为奇数,若最外层为nsx,则x=1,含有未成对电子;若最外层为ns2npy,则y=1或3或5,np轨道一定含有未成对电子,故D错误.
故选: ④④
考点:考查电子排布的相关知识点。


科目:高中化学 来源: 题型:填空题
(1)亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、
Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有________,看到的现象是 ________,反应的方程式为___________________________
(2)实验室制取氯气的化学方程式: 括号中为杂质,填上除杂试剂:Cl2中(HCl) 。
(3)由SiO2制取粗硅的化学方程式
(4)将ag由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为 ag (> ;< ;=)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下: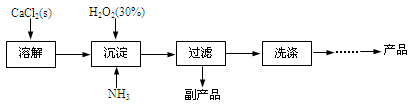
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
①11H、21H、31H为三种不同的核素 ②11H、21H、31H互为同位素
③11H、21H、31H互为同素异形体 ④11H、21H、31H同系物 ⑤11H、21H、31H同分异构体
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置
⑦互为同位素的原子性质相同
| A.①②⑥ | B.①②③⑥ | C.①②⑥⑦ | D.①②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是周期表中短周期的一部分。已知X原子最外层电子数比次外层电子数少3个,Z的单质是黄绿色气体。则下列说法中正确的是
| | W | |
| X | Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于碱金属元素和卤素的说法中,错误的是( )
| A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 |
| B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子能力最强 |
| C.钾与水的反应比钠与水的反应更剧烈 |
| D.溴单质与水的反应比氯单质与水的反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W做电极组成的原电池,电极反应为W2++2e- =W,Y-2e- =Y2+。可知X、Y、W、Z的还原性由强到弱的顺序是
| A.X>Z>Y>W | B.Z>W>X>Y | C.Z>X>Y>W | D.Z>Y>X>W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com