
【题目】下图是实验室进行氯气的制备及性质实验的组合装置,部分固定装置未画出。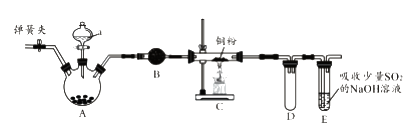
(1)A中固体是氯酸钾,液体a是浓盐酸,写出该反应的化学方程式:。
(2)B为干燥装置,加入的固体是;欲净化氯气,A、B间应添加一个盛有的洗气瓶。
(3)C中的反应现象是;D的作用是。
(4)已知E中发生的反应为:Cl2+Na2SO3+2NaOH ![]() 2NaCl+Na2SO4+H2O。E中吸收尾气一段时间后,吸收液(强碱性)中肯定存在:Cl-、OH-和SO42-。某兴趣小组认为该吸收液中还可能存在ClO-和SO32-。
2NaCl+Na2SO4+H2O。E中吸收尾气一段时间后,吸收液(强碱性)中肯定存在:Cl-、OH-和SO42-。某兴趣小组认为该吸收液中还可能存在ClO-和SO32-。
a.甲同学认为该吸收液中ClO-和SO32-不能同时存在,其理由是(用离子方程式表示)。
b.乙同学为了检验吸收液中是否含有SO32- , 取少量吸收液于试管中,加适量稀硫酸酸化后,滴加品红溶液,发现品红溶液褪色。据此推断该吸收液中一定有SO32-。乙同学的推断是否正确?(填“正确”或“不正确”),理由是。
c.请设计实验检验吸收液中是否含有ClO-(写出实验步骤、现象和结论)。
【答案】
(1)KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(2)五氧化二磷;饱和食盐水
(3)生成棕黄色的烟;安全瓶
(4)ClO-+SO32-=Cl-+SO42-;不正确;HClO具有漂白性,也能使品红溶液褪色取少量吸收液,加入适量稀硫酸酸化,再加入几滴石蕊溶液,若溶液先变红后褪色,则原溶液中含有ClO-;若溶液变红且不褪色,则原溶液中不含ClO-
【解析】(1)固体氯酸钾与浓盐酸混合可生成氯化钾和氯气,根据电子守恒和原子守恒,发生反应的化学方程式为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
(2)浓盐酸具有挥发性,制备的氯气中含有氯化氢和水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,选择盛有饱和食盐水洗气瓶除去氯化氢,五氧化二磷为酸性干燥剂,与氯气不反应,可以干燥氯气;
(3)在加热条件下Cu遇氯气,剧烈燃烧,产生棕黄色的烟;因氯气易溶于NaOH溶液,为防止产生倒吸现象,选择D装置作安全瓶;
(4)a.因ClO-有强氧化性,而SO32-有较强还原性,二者易发生反应ClO-+SO32-=Cl-+SO42- , 则吸收液中不可能同时存在ClO-和SO32-;
b.因吸收液中可能存在ClO- , 在酸性条件下HClO有漂白性,也能使品红褪色,故乙同学的推断不正确;
c.为检验吸收液中是否含有ClO- , 可取少量吸收液,加入适量稀硫酸酸化,再加入几滴石蕊溶液,若溶液先变红后褪色,则原溶液中含有ClO-;若溶液变红且不褪色,则原溶液中不含ClO-。
【考点精析】认真审题,首先需要了解氯气的化学性质(氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应),还要掌握氯气的实验室制法(实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O)的相关知识才是答题的关键.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】《斯德哥尔摩公约》禁用的12种持久性有机污染物之一是滴滴涕,其结构简式为  ,有关滴滴涕的说法正确的是( )
,有关滴滴涕的说法正确的是( )
A.它属于芳香烃
B.分子中最多有23个原子共面
C.分子式为C14H8Cl5
D.1mol该物质最多能与5mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时.c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是
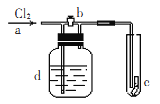
A. NaOH溶液 B. 饱和食盐水 C. Ca(OH)2溶液 D. 浓H2S04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法对人体健康不会造成危害的是( )
A.用工业盐(NaNO2)作咸味调味品
B.用硫磺熏制银耳,使它颜色更白
C.食盐中加入一定量的碘酸钾(KIO3)制取加碘食盐
D.将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯( ![]() )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下: 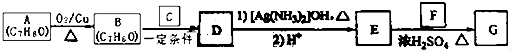 已知以下信息:
已知以下信息:
① ![]() ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22.
回答下列问题:
(1)A的化学名称为 .
(2)B和C反应生成D的化学方程式为 .
(3)F中含有官能团的名称为 .
(4)E和F反应生成G的化学方程式为 , 反应类型为 .
(5)F的同分异构体中不能与金属钠反应生成氢气的共有种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为写结构简式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成分SO2)来制取石膏(CaSO42H2O)和过二硫酸钠(Na2S2O8)。设计简要流程如图:
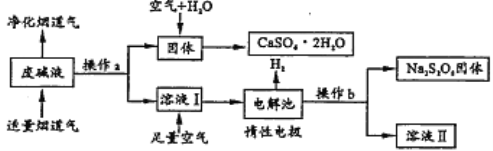
(1)烟道气中SO2与废碱生成沉淀的化学方程式为_____;操作a的名称是_____。
(2)生成CaSO42H2O过程中没有涉及到的化学反应类型为_____(填序号)。
A.复分解反应 B.化合反应 C.分解反应 D.氧化反应 E.置换反应
(3)溶液Ⅰ通入空气发生反应的化学方程式为_____。
(4)用惰性电极电解时,阳极生成Na2S2O8的电极反应为_____;在整个流程中可以循环利用的物质是H2O和_____(填化学式)。
(5)一定条件下将S8(s)、O2(g)、NaOH(s)转化过程中的能量关系用如图简单表示。则S8(s)燃烧的热化学反应方程式为_____。

(6)若制取ag Na2S2O8时,阳极有bL氧气(标况)产生。则电解生成的H2体积在标准状况下为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ag Mg、Al合金完全溶解在C1mol/L、V1LHCl溶液中,产生bmolH2。再向反应后的溶液中加入C2mol/LV2L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg。下列关系不正确的是
A. d=a+34b B. ![]()
C. 铝的质量为![]() D. 与金属反应后剩余盐酸为(C1V1-2b)mol
D. 与金属反应后剩余盐酸为(C1V1-2b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A. 2.4g金属镁变成镁离子时失去的电子数目为0.1NA
B. 常温下,2g氢气所含分子数目为NA
C. 在25℃,![]() 时,11.2L氮气所含的原子数目为NA
时,11.2L氮气所含的原子数目为NA
D. 标准状况下22.4L单质溴所含的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com