
【题目】NaNO3和Cu(NO3)2的混合溶液体积为500mL,测得其中c(NO3-)=6.0mol·L-1,用铂电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
A.电解得到铜的物质的量为0.5mol
B.上述电解过程中共转移2mol电子
C.原混合溶液中c(Na+)为2mol·L-1
D.电解后溶液中c(H+)为2mol·L-1
科目:高中化学 来源: 题型:
【题目】标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑色固体A加热至红热投入到无色溶液B中发生如图转化关系。
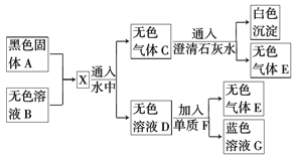
(1)由此可以推断:A为________(填化学式,下同),B为_______,X为_______,C为_________,E为_________。
(2)写出A与B反应的化学方程式: ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图所示装置探究浓硫酸与铜是否发生反应及反应所产生气体的性质。请回答下列问题:
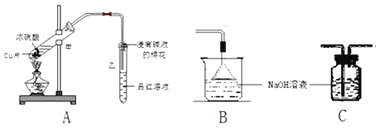
(1)写出试管甲中所发生反应的化学反应方式___。
(2)通过试管甲中溶液变为___色,乙中品红溶液___等现象,说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有___性。
(3)SO2的排放是造成酸雨的主要因素,为了减少SO2的排放,常用石灰(CaO)法对煤燃烧后的烟气脱硫,其原理是___(用化学方程式表示 )。
(4)SO2在适当的温度并有一定催化剂存在的条件下可以转化为SO3,其化学反应方程式为__。
(5)为防止二氧化硫造成空气污染,如果需要在装置末端增加尾气吸收装置,应选择的装置是__(填“B”或“C”)。
(6)硫酸有很多的性质,将下列性质对应的字母填入各小题后面对应的括号中:
A.脱水性 B.酸性 C.强氧化性 D.吸水性
①在化学实验中,浓硫酸可做SO2、CO2等气体的干燥剂。(______)
②Na2CO3与H2SO4反应,可生成Na2SO4和CO2。(______)
③向滤纸上滴加浓H2SO4 ,滤纸变黑。(______)
④在冷浓H2SO4中放入铁片没明显现象。(______)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO 和 NO 是汽车尾气中的主要污染物,易引起酸雨、温室效应和光化学烟雾等环境污染问题。随着我国机动车保有量的飞速发展, 汽车尾气的有效处理变得迫在眉睫。其中的一种方法为2CO(g)+2NO(g)=N2(g)+2CO2(g),请回答下列问题:
(1)已知该反应为自发反应,则该反应的反应热△H ______0(填“>”或“<”或“=”)
(2)已知:N2 (g) + O2(g)=2NO(g) △H= a kJmol -1
C(s) + O2 (g)=CO2 (g) △H= b kJmol -1
2C(s) + O2 (g)=2CO(g) △H= c kJmol -1
则 2CO(g)+2NO(g)=N2 (g)+2CO2 (g) △H=______kJmol-1 (用含 a、b、c 的表达式表示)。
(3)一定温度下,将 a molCO、b molNO 充入一恒压真空密闭容器。已知起始压强为 c kPa,到达平衡时, 测得N2 的物质的量为 d mol,则:
①该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=_____(用含 a、b、c、d 的式子表示)
②该条件下,可判断此反应到达平衡的标志是_____。
A.单位时间内,断裂 2n molC=0 同时形成 n mol N≡N
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
(4)某研究小组探究催化剂对 CO、NO 转化的影响。将 CO 和 NO 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 N2 的含量,从而确定尾气脱氮率(即 NO 的转化率),结果如图所示:
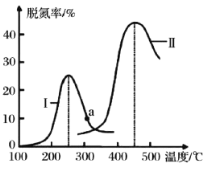
①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为_____________。
②若低于 200℃,图中曲线 I 脱氮率随温度升高变化不大的主要原因为________。
(5)己知常温下, Kb(NH3·H 2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11。此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)= ____mol/L,将脱氮反应后生成CO2 通入氨水中使溶液恰好呈中性,则此时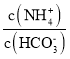 =____________(保留小数点后4位数字)
=____________(保留小数点后4位数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据新浪网报道:2019年8月2日,北京市房山区的瑞莱游泳健身馆发生疑似氯气泄漏,致多人呼吸道不适,出现头晕呕吐症状,61人送医治疗。氯气是一种重要的化工原料,在工农业生产生活中有着重要的应用。某化学兴趣小组同学利用以下装置制备氯气并对氯气的性质进行探究:
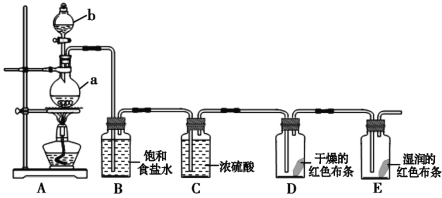
(1)仪器b的名称为___________。
(2)装置A中发生反应的离子方程式为:____________________________________。
(3)装置D中的实验现象为__________________,装置E中的实验现象为________
(4)整套实验装置存在着明显缺陷,你的改进措施是__________________________。
(5)8.7gMnO2固体与足量浓盐酸充分反应,在标准状况下产生Cl2的体积为_____L;其中被氧化的HCl的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组利用如图装置来制备无水AlCl3(已知:无水AlCl3178℃升华,遇水能迅速发生反应)。下列说法正确的是( )
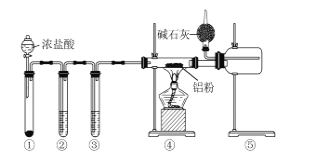
A.装置①中的试剂可能是二氧化锰
B.装置②、③中的试剂分别为浓硫酸、饱和食盐水
C.④和⑤之间使用粗玻璃管是为了防堵塞
D.球形干燥管中碱石灰的作用只有处理尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B![]() C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
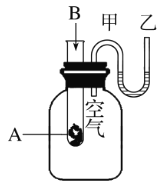
(1)该反应为________(填“放热”或“吸热”)反应。
(2)A和B的总能量比C和D的总能量_______(填“高”或“低”)。
(3)物质中的______能转化成______能释放出来。
(4)反应物化学键断裂吸收的能量__________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】花椒毒素(H)有抗实验性心律失常、镇痛、抗炎等作用。由芳香族化合物A为原料合成H的一种合成路线如下:
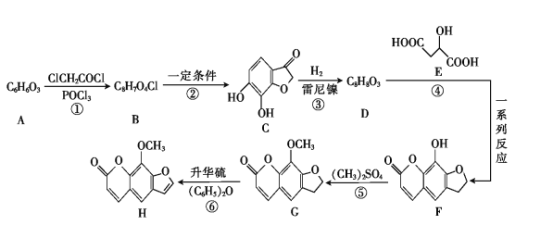
已知:![]() +ClCH2CH2Cl
+ClCH2CH2Cl![]()
![]() +HCl
+HCl
回答下列问题:
(1)A的化学名称是 _____(用系统命名法)。
(2)G中所含官能团的名称是 ____。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中___ (填“有”或“没有”)手性碳。
(4)反应⑥的反应类型是 ____ 。
(5)D的结构简式为 _____。
(6)F与足量NaOH溶液反应的化学方程式为 ____。
(7)芳香族化合物W是D的同分异构体,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应;W的核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1。符合上述要求的W有____种。
(8)有机物M(![]() )是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
)是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com