
【题目】乙酸甲酯是树脂、涂料、油墨、油漆、胶粘剂、皮革生产过程所需的有机溶剂,而且乙酸甲酯还可作为原料制备燃料乙醇。已知:乙酸甲酯可由乙酸和甲醇进行酯化反应得到。请回答下列问题:
(1)①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) H1=-874.5kJ/mol
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) H2=-1453kJ/mol
③2CH3COOCH3(l)+7O2(g)=6CO2(g)+6H2O(l) H3=-3189.8kJ/mol
由上述反应,可求出CH3COOH(l)+CH3OH(l)=CH3COOCH3(l)+H2O(l)的H=________![]() 。
。
(2)对于反应CH3COOH(l)+CH3OH(l)CH3COOCH3(l)+H2O(l),判断下列选项可以提高乙酸平衡转化率的是______
A.加入催化剂,增快反应速率
B.加入过量的甲醇
C.加入过量的乙酸
D.将乙酸甲酯从体系中分离
E.适当地提高反应温度
F.适当地降低反应温度
(3)在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇发生了两个反应:
主反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g) H<0,
副反应:CH3COOCH3(g)+H2(g) CH3OH(g)+CH3CHO(g) H>0,实验测得,在相同时间内,反应温度与CH3CH2OH和CH3CHO的产率之间的关系如图所示:
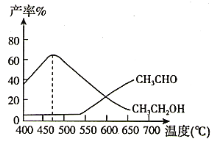
①在540℃之前CH3CHO的产率远低于CH3CH2OH产率的原因是________。
②在470℃之后CH3CHO与CH3CH2OH产率变化趋势可能的原因是________。
(4)若在470℃时,以n(CH3COOCH3):n(H2)=1:10的投料比只进行主反应(不考虑副反应),乙酸甲酯转化率与气体总压强的关系如图所示:
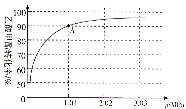
①A点时,CH3COOCH3(g)的平衡分压为________MPa,CH3CH2OH(g)的体积分数________%(保留一位小数)。
②470℃时,该反应的化学平衡常数Kp=________(MPa)-1(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
【答案】-6.1kJmol-1 BDF 副反应的活化能远大于主反应的活化能,副反应的化学反应速慢 470℃之后,乙醇的产率逐渐降低是该反应是放热反应,温度升高平衡逆向移动,乙醛的产率逐渐升高是反应速率逐渐加快,反应吸热平衡正向移动 0.01MPa 8.9 ![]()
【解析】
(1)依据热化学方程式和盖斯定律进行计算;
(2)A.加入催化剂,增快反应速率,并不会影响平衡移动;
B.加入过量的甲醇,增大了反应物浓度,使平衡正向移动,乙酸的转化率增大;
C.加人过量的乙酸,增大了反应物浓度,虽然使平衡正向移动,但乙酸的转化率降低;
D.将乙酸甲酯从体系中分离,使产物减少,促进平衡正向移动,乙酸的转化率增;
E.根据H为负值,反应正向是放热反应,因此,适当降低温度,平衡正向移动,乙酸的转化率增大;
(3)①两反应快慢的核心是活化能的大小,反应快活化能小,而反应慢活化能大;
②470℃之后,乙醇的产率逐渐降低是该反应是放热反应,温度升高平衡逆向移动,乙醛的产率逐渐升高是反应速率逐渐加快。
(4)利用三段式、化学平衡常数进行计算。
(1)依据热化学方程式和盖斯定律,①+![]() ②-
②-![]() ③可得到CH3COOH(l)+CH3OH(l)=CH3COOCH3(l)+H2O(l),则H=H1+
③可得到CH3COOH(l)+CH3OH(l)=CH3COOCH3(l)+H2O(l),则H=H1+![]() H2-
H2-![]() H3=-6.10 kJmol-1。
H3=-6.10 kJmol-1。
(2)A.加入催化剂,增快反应速率,并不会影响平衡移动,A项错误;
B.加入过量的甲醇,增大了反应物浓度,使平衡正向移动,乙酸的转化率增大,B项正确;
C.加人过量的乙酸,增大了反应物浓度,虽然使平衡正向移动,但乙酸的转化率降低,C项错误;
D.将乙酸甲酯从体系中分离,使产物减少,促进平衡正向移动,乙酸的转化率增大,D项正确;
E.根据H为负值,反应正向是放热反应,因此,适当降低温度,平衡正向移动,乙酸的转化率增大,E项错误,F项正确;
综上所述,答案为BDF。
(3)①两反应快慢的核心是活化能的大小,反应快活化能小,而反应慢活化能大,根据图像可知,副反应的活化能远大于主反应的活化能,副反应的化学反应速慢;
②470℃之后,乙醇的产率逐渐降低是该反应是放热反应,温度升高平衡逆向移动,乙醛的产率逐渐升高是反应速率逐渐加快,反应吸热平衡正向移动。
(4)①由图可看出,转化率为90%时,总压为1.01MPa,已知n(CH3COOCH3):n(H2)=1:10,列三行式求解:
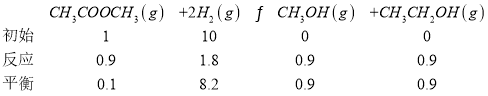
总压为1.01MPa,因此CH3COOCH3(g)的平衡分压为![]() ;CH3CH2OH(g)的体积分数即为物质的量分数,其体积分数
;CH3CH2OH(g)的体积分数即为物质的量分数,其体积分数![]() ;
;
②![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族; E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出元素符号:
A_______,B_______,C_________,D_________,E__________。
(2)画出E的阴离子的结构示意图:__________
(3)A的单质和C的单质在一定条件下反应生成化合物X,该反应的化学方程式为_________。向X的水溶液中滴入酚酞溶液,会观察到_____________。
(4)将9g B单质在足量的D单质中燃烧,所得气体通入1L lmol/L NaOH溶液中,完全吸收后,溶液中大量存在的离子是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:__________。
②某元素原子的最外层电子数等于次外层电子数:__________________ 。
③L 层电子数是M层电子数2倍的元素: ___________________ 。
④某同位素原子核内没有中子的元素: ___________________ 。
(2)写出1~18号元素中符合下列条件的原子(离子)的微粒符号和结构示意图。
①某元素原子L层上的电子数为K层的3倍: __________________ 。
②某元素原子L层上的电子数为K层的一半: _________________ 。
③得到2个电子后,电子总数与氩原子的电子总数相同的离子: ___________________ 。
④某元素原子的最外层电子数等于次外层电子数的2倍: ___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba3(PO4)2和BaHPO4不溶于水,Ba(H2PO4)2易溶于水,现将0.1mol/LBa(OH)2溶液加入至100mL同浓度的H3PO4溶液中,电流强度(I)与加入Ba(OH)2溶液的体积(V)之间的关系如图所示,下列说法正确的是( )
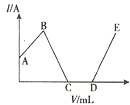
A.A~B段发生的反应为:H3PO4+Ba(OH)2=BaHPO4↓+2H2O
B.B点处加入Ba(OH)2溶液的体积V=10mL
C.C点处沉淀的质量为2.33g
D.D点处沉淀的物质的量为0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质中:①HCl、②N2、③NH3、④Na2O2、⑤C2H4、⑥NaOH、⑦Ar
(1)只存在极性键的分子是___;只由非极性键构成的非极性分子是__;(填序号,下同)。
(2)CO32﹣的中心原子的杂化轨道类型是__,微粒的空间构型是__。
(3)在K3[Fe(CN)6]中中心离子是__,配体是__,配位数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向某恒容密闭容器中充入一定量的A和B,发生反应:A(g)+B(g) ![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是( )。
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是( )。
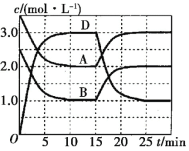
A.反应在前10min内的平均反应速率v(D)=0.15mol·L-1·min-1
B.该反应的平衡常数表达式为K=![]()
C.若平衡时保持温度不变,压缩容器容积,则平衡向逆反应方向移动
D.反应至15min时,改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年新冠肺炎疫情在全球多点爆发。新型冠状病毒对紫外线和热敏感,56℃持续30分钟、酒精、含氯消毒剂、过氧乙酸等均可有效灭活病毒。下列有关说法正确的是( )
A.84消毒液的有效成分是![]()
B.84消毒液与酒精混合使用可增强灭活病毒效果
C.加热能杀死病毒是因为蛋白质受热发生变性
D.聚丙烯树脂是生产无纺布口罩的初始原料之一,聚丙烯可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料合成中间体,其合成路线如图:
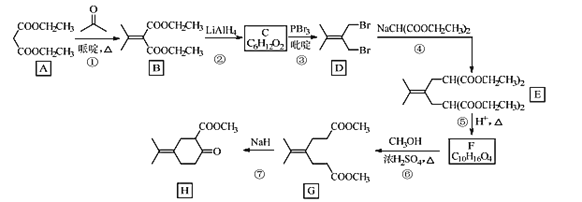
回答下列问题:
(1)A的化学名称是___。
(2)A到B的反应方程式是___。
(3)C的结构简式是___。
(4)④的反应类型是___。
(5)H中的含氧官能团的名称是___。
(6)X是F的同分异构体,X所含官能团的种类和数量与F完全相同,其核磁共振氢谱为三组峰,峰面积比为6:1:1。写出两种符合上述条件的X的结构简式___。
(7)设计由苯甲醇和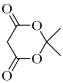 制备
制备 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)使用不同催化剂的调控中,研究人员发现,一定条件下,Pt 单原子催化剂有着高达 90.3%的甲醇选择性。反应历程如图,其中吸附在催化剂表面上的物种用*表示,TS 表示过渡态。
CH3OH(g)+H2O(g)使用不同催化剂的调控中,研究人员发现,一定条件下,Pt 单原子催化剂有着高达 90.3%的甲醇选择性。反应历程如图,其中吸附在催化剂表面上的物种用*表示,TS 表示过渡态。
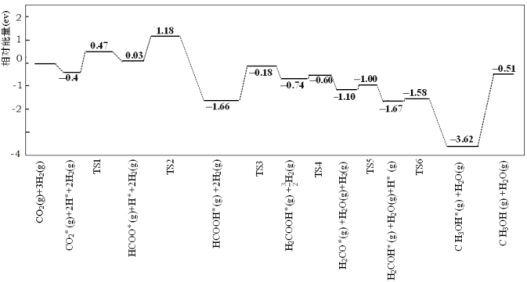
下列说法正确的是
A.该反应的△H>0
B.经历 TS1,CO2共价键发生断裂,且生成羧基
C.能垒(活化能)为 1.48ev 的反应为 HCOOH*(g)+2H2(g)=H2COOH*(g)+![]() H2(g)
H2(g)
D.如果换用铜系催化剂,所得反应历程与上图相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com