
【题目】已知Ba3(PO4)2和BaHPO4不溶于水,Ba(H2PO4)2易溶于水,现将0.1mol/LBa(OH)2溶液加入至100mL同浓度的H3PO4溶液中,电流强度(I)与加入Ba(OH)2溶液的体积(V)之间的关系如图所示,下列说法正确的是( )
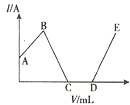
A.A~B段发生的反应为:H3PO4+Ba(OH)2=BaHPO4↓+2H2O
B.B点处加入Ba(OH)2溶液的体积V=10mL
C.C点处沉淀的质量为2.33g
D.D点处沉淀的物质的量为0.01mol
【答案】C
【解析】
A.A~B段电流强度增强,溶液中的离子浓度增大,则发生的反应:2H3PO4+Ba(OH)2= Ba(H2PO4)2+2H2O,A错误;
B.B点电流强度最强,则溶液中的溶质为Ba(H2PO4)2,则消耗50mLBa(OH)2,B错误;
C.B~C段电流强度减弱,生成BaHPO4沉淀,C点完全生成沉淀,共生成0.01molBaHPO4沉淀,沉淀质量为2.33g,C正确;
D.C~D段反应:2BaHPO4+Ba(OH)2=Ba3(PO4)2+2H2O,D点恰好完全反应,则0.01molBaHPO4沉淀转化为0.005mol Ba3(PO4)2沉淀,D错误;
答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.SO2、BF3、NH3分子中所有原子的最外层电子都满足8电子稳定结构
B.P4和CH4都是正四面体分子且键角都为109°28′
C.N2H4分子类似乙烯分子,其立体构型为平面正方形
D.AsH3分子的VSEPR构型为四面体形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)NH3是一种很好的配体,氨气分子是____(填“极性”或“非极性”)分子,NH3的沸点____(填“高于”“等于”或“低于”)AsH3。
(2)科学家通过X-射线测得胆矾的结构示意图可简单表示如图所示:

图中虚线表示的作用力为__________。
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4·SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是____,该原子团中心原子的杂化轨道类型是____。
(4)金属镍粉在CO气流中轻微加热,生成无色、有挥发性的液态Ni(CO)4,其分子呈正四面体构型。Ni(CO)4易溶于____(填字母)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是( )
A.1L0.1mol/LNaHCO3溶液中,HCO3-和CO32-的总数0.1NA
B.由![]() 和
和![]() 组成的1molO2中,含有质子的数目为16NA
组成的1molO2中,含有质子的数目为16NA
C.标准状况下,22.4L的乙醇与足量的氧气反应,生成CO2的数目为2NA
D.2molSO2和1molO2于密闭容器内充分反应后,生成SO3的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证Cl2、Fe3+、I2三者氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
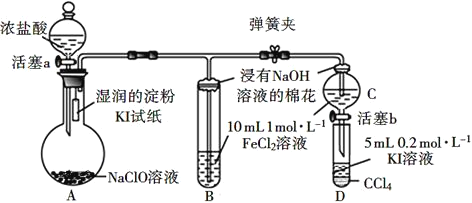
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,一段时间后,B中溶液红色加深,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,写出A中发生反应的化学反应方程式:___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中溶液发生反应的离子方程式是___。
(4)为验证Fe3+的氧化性强于碘单质,过程Ⅳ的操作和现象是___,对应反应的离子方程式是___。
(5)浸有氢氧化钠溶液的棉花作用是__。
(6)过程Ⅲ实验的目的是__。
(7)若将氯气通入无色碘化钾溶液中,无色溶液先变为黄色,继续通入氯气后,溶液又变为无色,已知每1molKI完全反应转移6mol电子,写出过量氯气与碘化钾溶液反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法正确的是
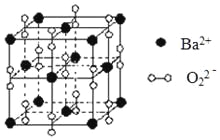
A.与每个Ba2+距离相等且最近的Ba2+共有6个
B.晶体中Ba2+的配位数为8
C.晶体的化学式为Ba2O2
D.该氧化物是含有非极性键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸甲酯是树脂、涂料、油墨、油漆、胶粘剂、皮革生产过程所需的有机溶剂,而且乙酸甲酯还可作为原料制备燃料乙醇。已知:乙酸甲酯可由乙酸和甲醇进行酯化反应得到。请回答下列问题:
(1)①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) H1=-874.5kJ/mol
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) H2=-1453kJ/mol
③2CH3COOCH3(l)+7O2(g)=6CO2(g)+6H2O(l) H3=-3189.8kJ/mol
由上述反应,可求出CH3COOH(l)+CH3OH(l)=CH3COOCH3(l)+H2O(l)的H=________![]() 。
。
(2)对于反应CH3COOH(l)+CH3OH(l)CH3COOCH3(l)+H2O(l),判断下列选项可以提高乙酸平衡转化率的是______
A.加入催化剂,增快反应速率
B.加入过量的甲醇
C.加入过量的乙酸
D.将乙酸甲酯从体系中分离
E.适当地提高反应温度
F.适当地降低反应温度
(3)在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇发生了两个反应:
主反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g) H<0,
副反应:CH3COOCH3(g)+H2(g) CH3OH(g)+CH3CHO(g) H>0,实验测得,在相同时间内,反应温度与CH3CH2OH和CH3CHO的产率之间的关系如图所示:
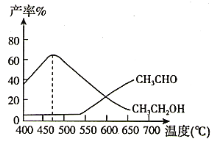
①在540℃之前CH3CHO的产率远低于CH3CH2OH产率的原因是________。
②在470℃之后CH3CHO与CH3CH2OH产率变化趋势可能的原因是________。
(4)若在470℃时,以n(CH3COOCH3):n(H2)=1:10的投料比只进行主反应(不考虑副反应),乙酸甲酯转化率与气体总压强的关系如图所示:
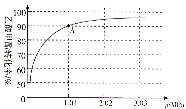
①A点时,CH3COOCH3(g)的平衡分压为________MPa,CH3CH2OH(g)的体积分数________%(保留一位小数)。
②470℃时,该反应的化学平衡常数Kp=________(MPa)-1(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不能达到相应实验目的的是( )
选项 | 实验目的 | 实验操作 |
A | 配制 | 先将 |
B | 比较醋酸与碳酸酸性的强弱 | 将 |
C | 检验溶液中是否含有 | 取少量试剂于试管中,加入浓 |
D | 试清洗碘升华实验所用试管 | 先用酒精清洗,再用水冲洗 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lg c(S2-)与lg c(M2+)关系如图所示。下列说法不正确的是
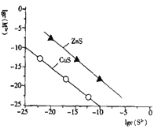
A.25℃时,Ksp(CuS)约为l×10-35
B.向Cu2+浓度为10-5mol/L废水中加入ZnS粉末,会有CuS沉淀析出
C.向l00mL浓度均为10-5mol/L Zn2+、Cu2+的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Cu2+先沉淀
D.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com