
【题目】为验证Cl2、Fe3+、I2三者氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
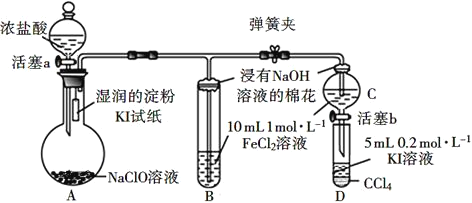
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,一段时间后,B中溶液红色加深,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,写出A中发生反应的化学反应方程式:___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中溶液发生反应的离子方程式是___。
(4)为验证Fe3+的氧化性强于碘单质,过程Ⅳ的操作和现象是___,对应反应的离子方程式是___。
(5)浸有氢氧化钠溶液的棉花作用是__。
(6)过程Ⅲ实验的目的是__。
(7)若将氯气通入无色碘化钾溶液中,无色溶液先变为黄色,继续通入氯气后,溶液又变为无色,已知每1molKI完全反应转移6mol电子,写出过量氯气与碘化钾溶液反应的离子方程式:___。
【答案】2HCl+NaClO=NaCl+Cl2↑+H2O A中湿润的淀粉KI试纸变蓝 Cl2+2Fe2+=2Fe3++2Cl- 打开活塞b,将C中少量黄色溶液滴入D中。关闭活塞b,取下D振荡,静置后CCl4层溶液变为紫(红)色 2I-+2Fe3+=2Fe2++I2↓ 吸收氯气等有毒气体,防止污染空气 确认C的黄色溶液中无Cl2,排除Cl2对Fe3+氧化碘离子实验的干扰 I-+3Cl2+3H2O=IO3-+6H++6Cl-
【解析】
验证卤素单质氧化性的相对强弱,装置A:84消毒液为次氯酸钠和氯化钠混合溶液,加入浓盐酸发生氧化还原反应生成氯气,装置A中生成氯气,烧瓶上端湿润的碘化钾淀粉试纸变蓝色,验证氯气的氧化性强于碘,装置B:装置B中盛有氯化亚铁溶液,氯气进入装置B中,氯气氧化亚铁离子为铁离子,溶液呈棕黄色,验证氯的氧化性强于亚铁离子,氯气有毒,能被氢氧化钠吸收,浸有氢氧化钠的棉花防止氯气污染空气,若将氯气通入无色碘化钾溶液中,无色溶液先变为黄色,继续通入氯气后,溶液又变为无色说明氯气氧化碘单质生成碘酸。
(1)A中产生黄绿色气体是氯气,即氯化钠和次氯酸钠在盐酸溶液中生成氯气,反应的化学方程式为:2HCl+NaClO=NaCl+Cl2↑+H2O;
(2)淀粉变蓝色,说明有单质碘生成,说明氯气氧化性强于单质碘;
(3)B中溶液发生反应是氯气氧化亚铁离子生成铁离子,反应的离子方程式是Cl2+2 Fe2+-=2Fe3++2Cl-;
(4)为验证铁离子的氧化性强于碘,应将C中生成的铁离子加入到盛有KI溶液的D中,如发生氧化还原反应,则静至后CCl4层溶液变为紫红色,对应反应的离子方程式为:2I-+2 Fe3+-=2Fe3++I2;
(5)浸有NaOH溶液的棉花作用是吸收尾气,防止氯气污染空气,离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O;
(6)为验证铁离子的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由浅绿色变为棕黄色时,说明有大量的铁离子生成,此时应关闭活塞a,否则氯气过量,影响实验结论;
(7)若将氯气通入无色碘化钾溶液中,无色溶液先变为黄色,继续通入氯气后,溶液又变为无色,已知每1mol KI完全反应转移6mol电子,说明碘离子被氧化为碘酸,反应的离子方程式为:I-+3Cl2+3H2O=IO3-+6H++6Cl-。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
A.利用图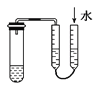 方法验证装置的气密性
方法验证装置的气密性
B.实验室里利用图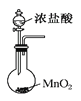 装置制备氯气
装置制备氯气
C.利用图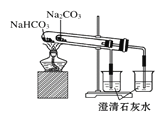 比较碳酸钠和碳酸氢钠的热稳定性
比较碳酸钠和碳酸氢钠的热稳定性
D.利用图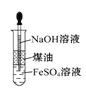 制备Fe(OH)2并能较长时间观察其颜色
制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的使用正确的是( )
A.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
B.Fe原子的外围电子排布图为![]()
C.氧的电负性比氮大,故氧元素的第一电离能比氮元素的第一电离能大
D.铜原子的外围电子排布式为3d94s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:__________。
②某元素原子的最外层电子数等于次外层电子数:__________________ 。
③L 层电子数是M层电子数2倍的元素: ___________________ 。
④某同位素原子核内没有中子的元素: ___________________ 。
(2)写出1~18号元素中符合下列条件的原子(离子)的微粒符号和结构示意图。
①某元素原子L层上的电子数为K层的3倍: __________________ 。
②某元素原子L层上的电子数为K层的一半: _________________ 。
③得到2个电子后,电子总数与氩原子的电子总数相同的离子: ___________________ 。
④某元素原子的最外层电子数等于次外层电子数的2倍: ___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:

(1)写出制取乙酸乙酯的化学反应方程式 ;
(2)浓硫酸的作用是: ;
(3)饱和碳酸钠溶液的主要作用是___ 。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是________________。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是__________。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba3(PO4)2和BaHPO4不溶于水,Ba(H2PO4)2易溶于水,现将0.1mol/LBa(OH)2溶液加入至100mL同浓度的H3PO4溶液中,电流强度(I)与加入Ba(OH)2溶液的体积(V)之间的关系如图所示,下列说法正确的是( )
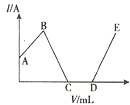
A.A~B段发生的反应为:H3PO4+Ba(OH)2=BaHPO4↓+2H2O
B.B点处加入Ba(OH)2溶液的体积V=10mL
C.C点处沉淀的质量为2.33g
D.D点处沉淀的物质的量为0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质中:①HCl、②N2、③NH3、④Na2O2、⑤C2H4、⑥NaOH、⑦Ar
(1)只存在极性键的分子是___;只由非极性键构成的非极性分子是__;(填序号,下同)。
(2)CO32﹣的中心原子的杂化轨道类型是__,微粒的空间构型是__。
(3)在K3[Fe(CN)6]中中心离子是__,配体是__,配位数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年新冠肺炎疫情在全球多点爆发。新型冠状病毒对紫外线和热敏感,56℃持续30分钟、酒精、含氯消毒剂、过氧乙酸等均可有效灭活病毒。下列有关说法正确的是( )
A.84消毒液的有效成分是![]()
B.84消毒液与酒精混合使用可增强灭活病毒效果
C.加热能杀死病毒是因为蛋白质受热发生变性
D.聚丙烯树脂是生产无纺布口罩的初始原料之一,聚丙烯可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乳酸的结构简式如图 a,下列叙述错误的是
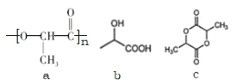
A.b 是合成聚乳酸的单体
B.1mol 乳酸与足量钠反应,生成 2mol 氢气
C.n mol 乳酸缩聚生成图 a 结构,同时生成 n molH2O
D.c 属于环酯,1molc 水解消耗 2molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com