
【题目】下列实验操作不能达到相应实验目的的是( )
选项 | 实验目的 | 实验操作 |
A | 配制 | 先将 |
B | 比较醋酸与碳酸酸性的强弱 | 将 |
C | 检验溶液中是否含有 | 取少量试剂于试管中,加入浓 |
D | 试清洗碘升华实验所用试管 | 先用酒精清洗,再用水冲洗 |
A.AB.BC.CD.D
【答案】B
【解析】
A.氯化铁溶液中存在平衡Fe3++3H2O3H++Fe(OH)3,先将其固体溶于较浓盐酸中,抑制Fe3+水解,故A正确;
B.测定![]() 溶液和
溶液和![]() 溶液的pH,比较的是醋酸和碳酸氢根离子的酸性强弱,故无法比较醋酸和碳酸的酸性强弱,若要比较醋酸钠和碳酸的酸性强弱,可以比较醋酸钠和碳酸氢钠的碱性强弱,酸的酸性越弱,形成的盐中酸根离子水解程度越大,盐的碱性越强,故B错误;
溶液的pH,比较的是醋酸和碳酸氢根离子的酸性强弱,故无法比较醋酸和碳酸的酸性强弱,若要比较醋酸钠和碳酸的酸性强弱,可以比较醋酸钠和碳酸氢钠的碱性强弱,酸的酸性越弱,形成的盐中酸根离子水解程度越大,盐的碱性越强,故B错误;
C.若溶液中含有![]() ,加入浓
,加入浓![]() 溶液并加热,铵根离子会和氢氧根离子反应释放出氨气,氨气可以使湿润的红色石蕊试纸变蓝,故C正确;
溶液并加热,铵根离子会和氢氧根离子反应释放出氨气,氨气可以使湿润的红色石蕊试纸变蓝,故C正确;
D.碘易溶于酒精,可用酒精清洗碘,又由于酒精与水互溶,再用水清洗酒精,试管能够清洗干净,故D正确;
答案选B。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】关于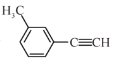 的说法正确的是
的说法正确的是
A.分子中有3种杂化轨道类型的碳原子
B.分子中共平面的原子数目最多为14
C.分子中的苯环由单双键交替组成
D.与Cl2发生取代反应生成两种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba3(PO4)2和BaHPO4不溶于水,Ba(H2PO4)2易溶于水,现将0.1mol/LBa(OH)2溶液加入至100mL同浓度的H3PO4溶液中,电流强度(I)与加入Ba(OH)2溶液的体积(V)之间的关系如图所示,下列说法正确的是( )
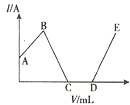
A.A~B段发生的反应为:H3PO4+Ba(OH)2=BaHPO4↓+2H2O
B.B点处加入Ba(OH)2溶液的体积V=10mL
C.C点处沉淀的质量为2.33g
D.D点处沉淀的物质的量为0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向某恒容密闭容器中充入一定量的A和B,发生反应:A(g)+B(g) ![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是( )。
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是( )。
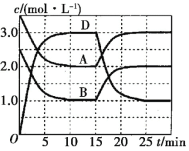
A.反应在前10min内的平均反应速率v(D)=0.15mol·L-1·min-1
B.该反应的平衡常数表达式为K=![]()
C.若平衡时保持温度不变,压缩容器容积,则平衡向逆反应方向移动
D.反应至15min时,改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年新冠肺炎疫情在全球多点爆发。新型冠状病毒对紫外线和热敏感,56℃持续30分钟、酒精、含氯消毒剂、过氧乙酸等均可有效灭活病毒。下列有关说法正确的是( )
A.84消毒液的有效成分是![]()
B.84消毒液与酒精混合使用可增强灭活病毒效果
C.加热能杀死病毒是因为蛋白质受热发生变性
D.聚丙烯树脂是生产无纺布口罩的初始原料之一,聚丙烯可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生课外活动小组利用下图所示装置分别做如下实验:
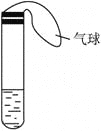
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料合成中间体,其合成路线如图:
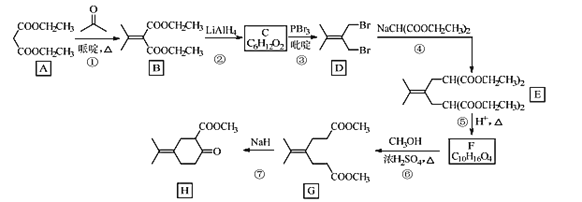
回答下列问题:
(1)A的化学名称是___。
(2)A到B的反应方程式是___。
(3)C的结构简式是___。
(4)④的反应类型是___。
(5)H中的含氧官能团的名称是___。
(6)X是F的同分异构体,X所含官能团的种类和数量与F完全相同,其核磁共振氢谱为三组峰,峰面积比为6:1:1。写出两种符合上述条件的X的结构简式___。
(7)设计由苯甲醇和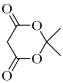 制备
制备 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1797年法国化学家沃克兰从当时称为红色西伯利亚矿石中发现了铬,后期人类发现铬元素在其他方面有重要用途。
(1)Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K____Cr (填“>”或“<”)。
(2)氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能,请写出Cr3+基态核外电子排布式为____;CrN 晶体类型与 NaCl 晶体相同,但前者熔点(1282℃)比后者(801℃)的高,主要原因是____。
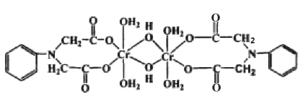
(3)Cr3+可与很多分子或离子形成配合物, 如图配合物中 Cr3+的配位数为_________,配体中采取sp3杂化的元素是__________。
(4)铬的一种氧化物的晶胞结构如图所示,其中氧离子与晶体镁堆积方式一致,铬离子在其八面体空隙中(如:CrA在O1、O2、O3、O4、O5、O6 构成的八面体空隙中)。
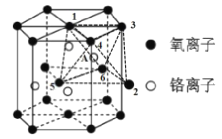
①该氧化物的化学式为 ______。
②该晶胞有 _____%八面体空隙未填充阳离子。
③已知氧离子半径a cm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为____g·cm-3(用含a、b和NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com