
【题目】化合物H是一种香料合成中间体,其合成路线如图:
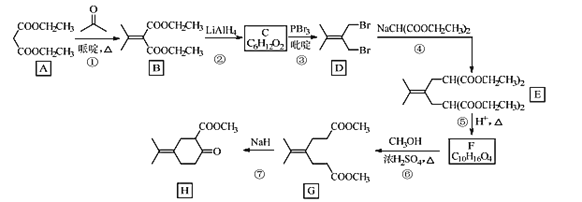
回答下列问题:
(1)A的化学名称是___。
(2)A到B的反应方程式是___。
(3)C的结构简式是___。
(4)④的反应类型是___。
(5)H中的含氧官能团的名称是___。
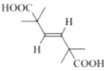
(6)X是F的同分异构体,X所含官能团的种类和数量与F完全相同,其核磁共振氢谱为三组峰,峰面积比为6:1:1。写出两种符合上述条件的X的结构简式___。
(7)设计由苯甲醇和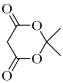 制备
制备 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
【答案】丙二酸二乙酯 
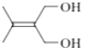 取代反应 羰基(酮基)、酯基
取代反应 羰基(酮基)、酯基 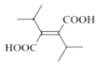 、
、 、
、 、
、 、
、 、
、

【解析】
![]() (A)与
(A)与![]() 在吡啶的作用下反应生成
在吡啶的作用下反应生成![]() (B);B与LiAlH4反应生成C,由C的分子式及前后物质的结构,可确定其结构简式为
(B);B与LiAlH4反应生成C,由C的分子式及前后物质的结构,可确定其结构简式为![]() ;由E、G结构及F的分子式,可确定F的结构简式为
;由E、G结构及F的分子式,可确定F的结构简式为![]() 。
。
(1)A的结构简式为![]() ,化学名称是丙二酸二乙酯。答案为:丙二酸二乙酯;
,化学名称是丙二酸二乙酯。答案为:丙二酸二乙酯;
(2) ![]() (A)与
(A)与![]() 在吡啶的作用下反应生成
在吡啶的作用下反应生成![]() (B),反应方程式是
(B),反应方程式是![]() 。答案为:
。答案为:![]() ;
;
(3)由以上分析知,C的结构简式是 。答案为:
。答案为: ;
;
(4)④为![]() ,与NaCH(COOCH2CH3)2反应生成
,与NaCH(COOCH2CH3)2反应生成![]() 和NaBr,反应类型是取代反应。答案为:取代反应;
和NaBr,反应类型是取代反应。答案为:取代反应;
(5)H的结构简式为![]() ,含氧官能团的名称是羰基(酮基)、酯基。答案为:羰基(酮基)、酯基;
,含氧官能团的名称是羰基(酮基)、酯基。答案为:羰基(酮基)、酯基;
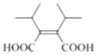
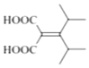
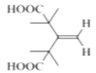
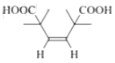
(6)X是![]() (F)的同分异构体,X所含官能团的种类和数量与F完全相同,其核磁共振氢谱为三组峰,峰面积比为6:1:1,则分子结构对称,含有4个-CH3、2个-COOH、1个碳碳双键,另外还含有4个季碳原子。符合上述条件的X的结构简式为:
(F)的同分异构体,X所含官能团的种类和数量与F完全相同,其核磁共振氢谱为三组峰,峰面积比为6:1:1,则分子结构对称,含有4个-CH3、2个-COOH、1个碳碳双键,另外还含有4个季碳原子。符合上述条件的X的结构简式为: 、
、 、
、 、
、 、
、 、
、 。答案为:
。答案为: 、
、 、
、 、
、 、
、 、
、 ;
;
(7)由苯甲醇和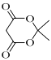 制备
制备![]() ,需利用A→B的信息,所以应先将苯甲醇氧化为苯甲醛,然后与
,需利用A→B的信息,所以应先将苯甲醇氧化为苯甲醛,然后与 反应生成
反应生成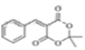 ,最后水解得到目标有机物。合成路线为:
,最后水解得到目标有机物。合成路线为: 。答案为:
。答案为: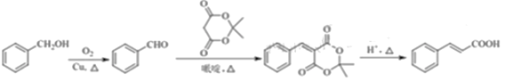 。
。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】第四周期的Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)NH3是一种很好的配体,氨气分子是____(填“极性”或“非极性”)分子,NH3的沸点____(填“高于”“等于”或“低于”)AsH3。
(2)科学家通过X-射线测得胆矾的结构示意图可简单表示如图所示:

图中虚线表示的作用力为__________。
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4·SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是____,该原子团中心原子的杂化轨道类型是____。
(4)金属镍粉在CO气流中轻微加热,生成无色、有挥发性的液态Ni(CO)4,其分子呈正四面体构型。Ni(CO)4易溶于____(填字母)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸甲酯是树脂、涂料、油墨、油漆、胶粘剂、皮革生产过程所需的有机溶剂,而且乙酸甲酯还可作为原料制备燃料乙醇。已知:乙酸甲酯可由乙酸和甲醇进行酯化反应得到。请回答下列问题:
(1)①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) H1=-874.5kJ/mol
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) H2=-1453kJ/mol
③2CH3COOCH3(l)+7O2(g)=6CO2(g)+6H2O(l) H3=-3189.8kJ/mol
由上述反应,可求出CH3COOH(l)+CH3OH(l)=CH3COOCH3(l)+H2O(l)的H=________![]() 。
。
(2)对于反应CH3COOH(l)+CH3OH(l)CH3COOCH3(l)+H2O(l),判断下列选项可以提高乙酸平衡转化率的是______
A.加入催化剂,增快反应速率
B.加入过量的甲醇
C.加入过量的乙酸
D.将乙酸甲酯从体系中分离
E.适当地提高反应温度
F.适当地降低反应温度
(3)在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇发生了两个反应:
主反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g) H<0,
副反应:CH3COOCH3(g)+H2(g) CH3OH(g)+CH3CHO(g) H>0,实验测得,在相同时间内,反应温度与CH3CH2OH和CH3CHO的产率之间的关系如图所示:
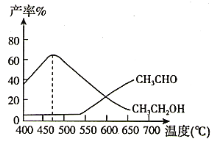
①在540℃之前CH3CHO的产率远低于CH3CH2OH产率的原因是________。
②在470℃之后CH3CHO与CH3CH2OH产率变化趋势可能的原因是________。
(4)若在470℃时,以n(CH3COOCH3):n(H2)=1:10的投料比只进行主反应(不考虑副反应),乙酸甲酯转化率与气体总压强的关系如图所示:
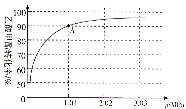
①A点时,CH3COOCH3(g)的平衡分压为________MPa,CH3CH2OH(g)的体积分数________%(保留一位小数)。
②470℃时,该反应的化学平衡常数Kp=________(MPa)-1(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不能达到相应实验目的的是( )
选项 | 实验目的 | 实验操作 |
A | 配制 | 先将 |
B | 比较醋酸与碳酸酸性的强弱 | 将 |
C | 检验溶液中是否含有 | 取少量试剂于试管中,加入浓 |
D | 试清洗碘升华实验所用试管 | 先用酒精清洗,再用水冲洗 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三电极电解水制氢的装置如图,三电极为催化电极a、催化电极b和Ni(OH)2电极。通过控制开关连接K1或K2,可交替得到H2和O2。下列说法错误的是( )
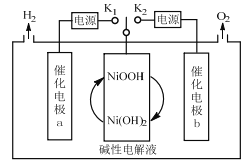
A.制O2时,电子由Ni(OH)2电极通过外电路流向催化电极b
B.制H2时,阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O
C.催化电极b上,OH-发生氧化反应生成O2
D.该装置可在无隔膜的条件下制备高纯氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是
A. 6个碳原子有可能都在一条直线上 B. 6个碳原子不可能都在一条直线上
C. 6个碳原子有可能都在同一平面上 D. 6个碳原子不可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是
①20mL 0.01mol·L-1 KCl溶液 ②30mL 0.02mol·L-1 CaCl2溶液③40mL 0.03mol·L-1 HCl溶液
A.①>③>②B.①>②>③C.②>①>③D.③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lg c(S2-)与lg c(M2+)关系如图所示。下列说法不正确的是
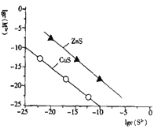
A.25℃时,Ksp(CuS)约为l×10-35
B.向Cu2+浓度为10-5mol/L废水中加入ZnS粉末,会有CuS沉淀析出
C.向l00mL浓度均为10-5mol/L Zn2+、Cu2+的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Cu2+先沉淀
D.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图所示,导管出口高于液面)。
⑥测量收集到的气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
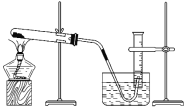
回答下列问题:
(1)如何检查装置的气密性 ____________________________________________。
(2)以下是测量收集到的气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是__________(请填写步骤代号)。
(3)测量收集到的气体体积时,如何使量筒内外液面的高度相同?________________。
(4)如果实验中得到的氧气体积是c L(25 ℃、1.01×105 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简)M(O2)=_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com