
����Ŀ��F��������ϩ�����Ļ��ġ���úΪԭ����ȡF��һ�ֺϳ�·�����£�

(1)���ô���Fe�����ڱ���λ��Ϊ��__________��̬Mnԭ�Ӽ۵��ӵ����Ų�ʽΪ��__________ ��
(2)�ٵļӹ��ֶγ�Ϊú __________(������������Һ��������������)��
(3)�ڡ��ܷ�Ӧ����������________��________��
(4)E������������������________��________��
(5)C��A��Ϊͬϵ�C�Ļ�ѧ������________��F�Ľṹ��ʽΪ ________��
(6)��Ӧ�ܵĻ�ѧ����ʽΪ____________��
���𰸡��������ڵ�VIII�� 3d54s2 ���� �ӳɷ�Ӧ ȡ����Ӧ(��������Ӧ) ̼̼˫�� ���� ��ϩ ![]() CH2��CHCOOH+C2H5OH
CH2��CHCOOH+C2H5OH![]() CH2��CHCOOC2H5+H2O
CH2��CHCOOC2H5+H2O
��������
��������ú��ˮ������Ӧ�Ƶ�CO��H2��CO��H2�ڴ������ȵ������ºϳ�A(��ϩ)��C��AΪͬϵ�����CΪ��ϩ����ϩ��ˮ�����ӳɷ�Ӧ����BΪ�Ҵ�����ϩ����������Ӧ�Ƶ�D��D��B����������Ӧ����E������E�Ľṹ��ʽ��֪D�Ľṹ��ʽΪCH2=CHCOOH��E�к���̼̼˫���������Ӿ۷�Ӧ����FΪ![]() ��
��
(1)FeΪ26��Ԫ�أ�λ�ڵ������ڵ�VIII�壻MnԪ��Ϊ25��Ԫ�أ���̬ԭ�Ӻ�������Ų�Ϊ[Ar]3d54s2���۵����Ų�Ϊ3d54s2��
(2)�ٵļӹ��ֶ�ú��������
(3)��Ӧ��Ϊ��ϩ��ˮ�ļӳɷ�Ӧ����Ӧ��Ϊ�Ҵ��ͱ�ϩ���������Ӧ(��ȡ����Ӧ)��
(4)����E�Ľṹ��ʽ��֪�������Ϊ̼̼˫����������
(5)C�ķ���ʽΪC3H6������ϩΪͬϵ�����̼̼˫��������CΪ��ϩ��E�����Ӿ۷�Ӧ����F������FΪ![]() ��
��
(6)��Ӧ��Ϊ�Ҵ��ͱ�ϩ���������Ӧ����ѧ����ʽΪCH2=CHCOOH+C2H5OH![]() CH2=CHCOOC2H5+H2O��
CH2=CHCOOC2H5+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������Ʊ���ˮ��������茶���[NH4Fe(SO4)2��6H2O]��һ�ַ�������:

(1) �����Լ�B��Ŀ����____________��
(2) ����������к���笠�����,������_____��Һ���ȼ���,���������峣��____���顣
(3) д�������ӡ���Ӧ�����ӷ���ʽ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Y(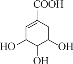 )�����в�ҩ�屶���Ʊ����ɡ�
)�����в�ҩ�屶���Ʊ����ɡ�
(1) Y����_____����������������)��
(2) Y�к������������Ȼ���_____(������)��
(3) ��Y��Һ�е�����ˮ,��ˮ��ɫ,˵��Y�к���_____��
(4) Y���л�ԭ�ԡ���Y��Һ�е��뼸������KMnO4ϡ��Һ,ʵ������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ڴ��������еĵ�����������Ļ�ѧ��ӦΪ:2NH3(g)+NO(g)![]() 2N2(g)+3H2O(g) ��H<0�ں����ܱ�������,�����й�˵����ȷ����( )
2N2(g)+3H2O(g) ��H<0�ں����ܱ�������,�����й�˵����ȷ����( )
A.ƽ��ʱ,������������,�����¶�ƽ��������Ӧ�����ƶ�
B.ƽ��ʱ,������������,����NH3��Ũ��,�����е��������ת���ʼ�С
C.��λʱ��������NO��N2�����ʵ�����Ϊ1:2ʱ,��Ӧ�ﵽƽ��
D.������������,ʹ�ø�Ч����,�����е��������ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaC2����ľ����ṹ��NaCl�����ƣ���ͼ������CaC2�����к���������C22���Ĵ��ڣ�ʹ������һ���������������й���CaC2�����˵������ȷ���ǣ�������

A. 6.4 g CaC2�����������0.2 mol
B. 1��Ca2+��Χ��������ҵȾ����C22����ĿΪ6
C. �þ����е���������N2�ǻ�Ϊ�ȵ�����
D. ��ÿ��Ca2+��������������Ca2+����12��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ʵ����
A.ǿ����ǿ���к͵ζ�ʱ����ѡ�ü��Ȼ��̪��ָʾ����ǿ���������к͵ζ�ʱӦ��ѡ�÷�̪��ָʾ��
B.��5![]() ��
��![]() ��Һ�м���3mL��Ũ�ȵ�NaCl��Һ���а�ɫ�����������ټ���3mL��Ũ�ȵ�
��Һ�м���3mL��Ũ�ȵ�NaCl��Һ���а�ɫ�����������ټ���3mL��Ũ�ȵ�![]() ��Һ����Һ�����к�ɫ�������ɣ�˵��
��Һ����Һ�����к�ɫ�������ɣ�˵��![]()
C.���ʵ���Ũ�Ⱦ�Ϊ![]() ������HX������NaX��Һ�������Ϻ�
������HX������NaX��Һ�������Ϻ�![]()
![]()
D.��֪![]() ��
��![]() ���ں�
���ں�![]() ��
��![]() Ũ����ͬ����Һ�еμ�
Ũ����ͬ����Һ�еμ�![]() ��Һʱ����������
��Һʱ����������![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I����п��ijŨ�ȵ����ᷴӦ��ʵ���У�ʵ��Ա�õ�����Ľ����
п������(g) | п����״ | �¶�(��) | �ܽ����Ứ��ʱ��(s) | |
A | 2 | ��Ƭ | 5 | 400 |
B | 2 | ��Ƭ | 15 | 200 |
C | 2 | ��Ƭ | 25 | 100 |
D | 2 | ��Ƭ | 35 | 50 |
E | 2 | ��Ƭ | 45 | 25 |
F | 2 | ��ĩ | 15 | 5 |
(1)д����̬Zn2+�ĺ�������Ų�ʽ��_____���÷�Ӧ��_____��Ӧ(��������������������)��
(2)��ϸ�۲�A��F��ʵ�����ݶԱȣ�����Եõ������¶�Ӱ�췴Ӧ���ʽ��ۣ��ô˽��ۣ����㣺55��ʱ��2gп��Ƭ�ܽ��������軨 _____s��
II��ij���淴Ӧ��ij���Ϊ5 L���ܱ������н��У��ڴ�0~4���Ӹ����ʵ����ı仯�����ͼ��ʾ(X
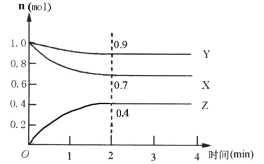
(3)�÷�Ӧ�ĵĻ�ѧ����ʽΪ__________________��
(4)��Ӧ��ʼ��2����ʱ��X��ƽ����Ӧ����Ϊ__��
(5)��˵���÷�Ӧ�Ѵﵽƽ��״̬����_________��
a��ÿ����1molX��ͬʱ����1.33molZ b��������ѹǿ���ֲ���
c��Z��Ũ�Ȳ��ٱ仯 d�������ڻ��������ܶȱ��ֲ���
(6)����ͼ���ƽ��ʱY��ת����Ϊ__________________��
(7)����������������䣬����He�������ڷ�Ӧ���ʽ�_______��(��������������С������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.100 mol��L-1 AgNO3�ζ�50.0 mL 0.0500 mol��L-1 Cl-��Һ�ĵζ�������ͼ��ʾ�������й�����������ǣ� ��

A.�����������ݼ����֪Ksp(AgCl)��������Ϊ10-10
B.�����ϸ������Һ�����ϵʽc(Ag+)��c(Cl-)=Ksp(AgCl)
C.��ͬʵ�������£�����Ϊ0.0500 mol��L-1 Br-����Ӧ�յ�c��b�����ƶ�
D.��ͬʵ�������£�����Ϊ0.0400 mol��L-1 Cl-����Ӧ�յ�c�Ƶ�a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����Ƭ��ͭƬ������ͭ��Һ���Թ���ԭ��ػ���أ�����˵������ȷ���ǣ�������

A.����ԭ���ʱ��Cu����ӦΪ![]()
B.���ɵ���ʱ��Fe�缫����һ������
C.���ɵ���ʱ��Cu��������������Ҳ���ܼ���
D.���ɵ�ԭ��ػ�����ڹ���ʱ�ķ�Ӧԭ��������ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com