
【题目】下列实验装置设计正确,且能达到目的的是
A.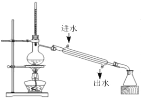 石油的分馏B.
石油的分馏B.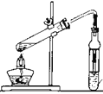 制备乙酸乙酯
制备乙酸乙酯
C.![]() 分离乙酸和乙醇D.
分离乙酸和乙醇D.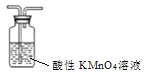 除甲烷中的乙烯
除甲烷中的乙烯
科目:高中化学 来源: 题型:
【题目】下列关于电化学的实验事实正确的是( )
出现环境 | 实验事实 | |
A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
B | 电解CuCl2溶液 | 电子经过负极→阴极 |
C | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
D | 将钢闸门与外加电源负极相连 | 牺牲阳极阴极保护法,可防止钢闸门腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭、纯碱(Na2CO3)和小苏打(NaHCO3)在生产、生活中应用广泛。完成下列填空:
(1)活性炭可用于处理大气污染物NO:![]() ,已知NO的转化率随温度升高而降低。降低温度,重新达到平衡,判断下列各物理量的变化:(选填“增大”、“减小”或“不变”)
,已知NO的转化率随温度升高而降低。降低温度,重新达到平衡,判断下列各物理量的变化:(选填“增大”、“减小”或“不变”)![]() __________;N2的体积分数___________;平衡常数K____________。
__________;N2的体积分数___________;平衡常数K____________。
(2)将氨气和二氧化碳先后通入饱和食盐水中,可观察到的现象是_______;写出相关反应的化学方程式______________
(3)小苏打既能跟酸反应,又能跟碱反应,应用勒夏特列原理进行解释。_____________
(4)比较同温下浓度均为0.01mol/L的①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3四种溶液中![]() 的大小关系为_______(用编号表示)。
的大小关系为_______(用编号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) ![]() KCl(l)+NaAlSi3O8(s),完成下列填空:
KCl(l)+NaAlSi3O8(s),完成下列填空:
(1)上述反应涉及的第三周期元素中,离子半径最小的是___;Cl原子与Si原子可构成有5个原子核的分子,其分子的空间构型为____。
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态_____。
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为__;NaAlSi3O8改写成氧化物形式是___。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
1.5 | 2.5 | 3.0 | 3.5 | 4.0 | |
800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
分析数据可以得出,氯化钠熔浸钾长石是__________反应(填“放热”或“吸热”);在950℃时,欲提高熔出钾的速率可以采取的一种措施是_______。
(5)Na(l)+KCl(l) ![]() NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是___。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是___。
(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
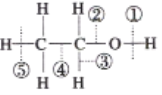
A. 和金属钠反应时键①断裂,发生置换反应
B. 在铜催化下与O2共热反应时断裂①和③,发生氧化反应
C. 与浓硫酸共热170°C下,主要断裂①和②,发生取代反应
D. 在空气中完全燃烧时断裂①②③④⑤,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 可简写为
可简写为![]() ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: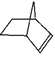
(1)降冰片烯属于__________。
A.环烃 B.烷烃 C.不饱和烃 D.芳香烃
(2)降冰片烯的分子式为____________.
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为________.
(4)推断降冰片烯应该具有的性质是__________。
A.能溶于水 B.能使高锰酸钾溶液褪色
C.能与氢气发生加成反应 D.常温常压下为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,6-己二酸是合成高分子化合物尼龙的重要原料之一,可用六个碳原子的化合物氧化制备。如图是合成尼龙的反应流程:
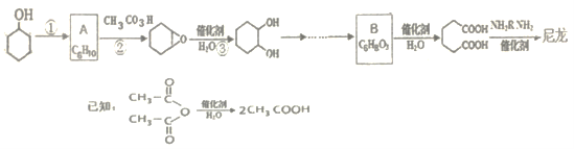
完成下列填空:
(1)写出反应类型:反应①_____反应②_______。
(2)A和B的结构简式为_______、_______。
(3)由![]() 合成尼龙的化学方程式为___。
合成尼龙的化学方程式为___。
(4)由A通过两步制备1,3-环己二烯的合成线路为:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com