
【题目】活性炭、纯碱(Na2CO3)和小苏打(NaHCO3)在生产、生活中应用广泛。完成下列填空:
(1)活性炭可用于处理大气污染物NO:![]() ,已知NO的转化率随温度升高而降低。降低温度,重新达到平衡,判断下列各物理量的变化:(选填“增大”、“减小”或“不变”)
,已知NO的转化率随温度升高而降低。降低温度,重新达到平衡,判断下列各物理量的变化:(选填“增大”、“减小”或“不变”)![]() __________;N2的体积分数___________;平衡常数K____________。
__________;N2的体积分数___________;平衡常数K____________。
(2)将氨气和二氧化碳先后通入饱和食盐水中,可观察到的现象是_______;写出相关反应的化学方程式______________
(3)小苏打既能跟酸反应,又能跟碱反应,应用勒夏特列原理进行解释。_____________
(4)比较同温下浓度均为0.01mol/L的①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3四种溶液中![]() 的大小关系为_______(用编号表示)。
的大小关系为_______(用编号表示)。
【答案】减小 增大 增大 溶液中有白色沉淀生成 NH3+CO2+NaCl+H2O→NH4Cl+NaHCO3↓ 当NaHCO3溶液加入酸时,促进了HCO3-的水解,生成CO2;当加入碱时,促进了HCO3-的电离,生成碳酸正盐。 ②>③>④>①
【解析】
(1)NO的转化率随温度升高而降低,说明该反应为放热反应,则降低温度后平衡向着正向移动,反应速率减小、氮气体积分数和平衡常数都增大;
(2)氨气极易溶于水,饱和食盐水中先通入氨气再通入二氧化碳会析出碳酸氢钠晶体;
(3)碳酸氢钠在溶液中存在电离平衡HCO3- H++CO32-,水解平衡:HCO3-+H2OH2CO3+OH-;当加入酸时促进了HCO3-的水解;当加入碱时促进了HCO3-的电离;
(4) H2CO3为二元弱酸,分步电离,以第一步电离为主,溶液中c(CO32-)最小;Na2CO3在溶液中电离出碳酸根离子,碳酸根离子的水解程度较小,其溶液中c(CO32-)最大;NaHCO3在溶液中,碳酸氢根离子的水解程度大于其电离程度,溶液中碳酸根离子浓度较小;NH4HCO3溶液中,铵根离子水解溶液呈酸性,抑制了碳酸氢根离子的电离,据此进行解答。
(1)反应![]() 中,NO的转化率随温度升高而降低,说明升高温度平衡向着逆向移动,则该反应为放热反应;若降低温度,正逆反应速率都减小,平衡向着吸热的正反应进行,氮气的物质的量增大,则N2的体积分数增大;因为降低温度后氮气和二氧化碳的浓度增大,NO的浓度减小,则平衡常数增大;
中,NO的转化率随温度升高而降低,说明升高温度平衡向着逆向移动,则该反应为放热反应;若降低温度,正逆反应速率都减小,平衡向着吸热的正反应进行,氮气的物质的量增大,则N2的体积分数增大;因为降低温度后氮气和二氧化碳的浓度增大,NO的浓度减小,则平衡常数增大;
答案是:减小;增大;增大;
(2)将氨气和二氧化碳先后通入饱和食盐水中发生反应:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓;则溶液中会有白色沉淀生成;
答案是:溶液中有白色沉淀生成;NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓;
(3)碳酸氢钠在溶液中存在电离平衡:HCO3-H++CO32-,水解平衡:HCO3-+H2OH2CO3+OH-;当NaHCO3溶液加入酸时,减小了c(OH-),促进了HCO3-的水解,生成CO2;当加入碱时,减小了c(H+),促进了HCO3-的电离,抑制了HCO3-的水解,生成了碳酸正盐;
答案是:当NaHCO3溶液加入酸时,促进了HCO3-的水解,生成CO2;当加入碱时,促进了HCO3-的电离,生成碳酸正盐;
(4)③④相比较,④中铵根离子水解呈酸性,抑制了碳酸氢根离子的电离,c(CO32-)大小为:③>④;①为二元弱酸,c(CO32-)最小;②Na2CO3在溶液中电离出钠离子和碳酸根离子,碳酸根离子水解程度较小,则其溶液中c(CO32-)最大,所以c(CO32-)的大小关系为: Na2CO3> NaHCO3> NH4HCO3> H2CO3,即: ②>③>④>①;
答案是: ②>③>④>①。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据框图分析,下列说法不正确的是
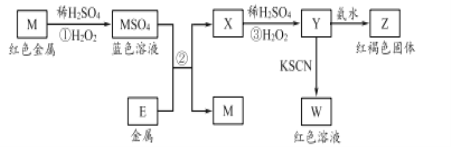
A. 我国是世界上最早使用反应②冶炼金属M的国家
B. M2+的氧化性比E2+的氧化性强
C. 在反应③中若不加稀硫酸,可能观察到红褐色沉淀
D. 在反应①中稀硫酸既表现出氧化性又表现出酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
|
A | NH3 | 浓氨水 | 碱石灰 | 碱石灰 | |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | NO | 稀硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 溶液中②、③点水的电离程度:③>②
C. 点②所示溶液中:c(Na+)=c(CH3COO-)=c(H+)=c(OH-)
D. 该滴定过程应该选择甲基橙作为指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个2L的密闭容器中,发生反应: 2SO3 (g)![]() 2SO2 (g)+ O2 (g) — Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是
2SO2 (g)+ O2 (g) — Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是

A. 0~8min内v(SO3)=0.025mol/(L·min)
B. 8min时,v逆(SO2)=2v正(O2)
C. 8min时,容器内压强保持不变
D. 若8min时将容器压缩为1L,n(SO3)的变化如图中a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为______;
(2)5.4g H2O所含氢原子数目与_____L(标准状况)氨气所含氢原子数目相等;
(3)A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下所示(反应条件及其他物质已经略去): A![]() B
B![]() C
C![]() D
D
a.若A是一种金属,C是淡黄色固体,写出C的一种用途________;
b.若A为淡黄色固体单质,实验室常用于检验B的试剂是__________;
c.若A是化合物,C是红棕色气体,则D的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
A. 制取及观察Fe(OH)2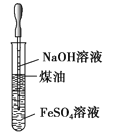
B. 比较两种物质的热稳定性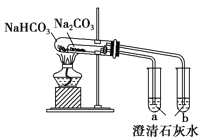
C. 实验室制取NH3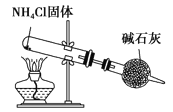
D. 分离沸点不同且互溶的液体混合物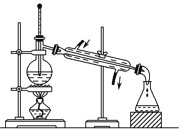
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列说法正确的是___________
A.化学反应的实质就是旧化学键的断裂,新化学键的形成,在化学反应中,反应物转化为生成物的同时,必然伴随着能量的变化
B.钢铁生锈腐蚀时,铁被氧化
C.放热反应发生时,不一定要加热。但吸热反应必须要加热才能发生
(2)在 101 kPa 时,2g H2完全燃烧生成液态水,放出285.8kJ 热量,氢气燃烧的热化学方程式表示为___________________________;
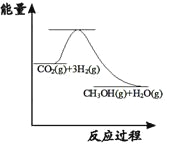
(3)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g);
CH3OH(g) +H2O(g);
下图表示该反应进行过程中能量的变化。(单位为:kJ·mol-1)该反应是___________(填“吸热”或“放热”)反应。ΔH__________0(填“>”或“<”)。
(4)比较下面各组热化学方程式,ΔH1<ΔH2的是________。
A.2H2(g)+O2(g)=2H2O(g)ΔH1;2H2(g)+O2(g)=2H2O(1)ΔH2
B.S(g)+O2(g)=SO2(g)ΔH1;S(s)+O2(g)=SO2(g)ΔH2
C.C(s)+1/2O2(g)=CO(g)ΔH1;C(s)+O2(g)=CO2(g)ΔH2
D.H2(g)+Cl2(g)=2HCl(g)ΔH1;1/2H2(g)+1/2Cl2(g)=HCl(g)ΔH2
(5)101 kPa条件下,14g N2和3g H2反应生成NH3的能量变化如下图示意:
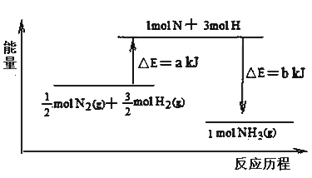
又已知:①已知b=1173;②25 ℃、101 kPa下N2(g)+3H2(g)![]() 2 NH3(g) ΔH =-92 kJ·mol-1则a =_________________。
2 NH3(g) ΔH =-92 kJ·mol-1则a =_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com