
| A、2.5×1019个 |
| B、2.5×1022个 |
| C、5×1019个 |
| D、5×1022个 |
| m |
| M |
| 5×10-4g |
| 12g/mol |
| 5 |
| 12 |
| 5 |
| 12 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、元素铯的两种核素137Cs比133Cs多4个质子 |
| B、元素P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
| C、元素原子的最外层电子数越多,越容易得电子 |
| D、从上到下,第VIIA族元素氢化物的热稳定性和还原性均依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤⑥ | B、①③⑥ |
| C、①③④⑥ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、44.8L | B、33.6L |
| C、22.4L | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.4g |
| B、1.4g |
| C、2.2g |
| D、在2.2g和4.4g之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
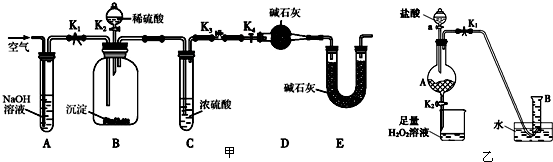
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
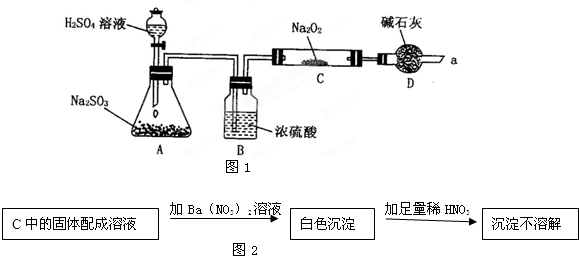
查看答案和解析>>
科目:高中化学 来源: 题型:
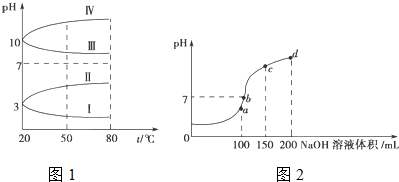
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com