
【题目】有下列五种物质①H2O ②HClO ③NH4Cl ④Na2O2 ⑤干冰。
(1)既存在离子键又存在共价键的是__________。
(2)写出④的电子式_________,⑤的电子式_________。
【答案】③④ ![]()
![]()
【解析】
一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,注意氯化铝中只含共价键,铵盐中含有离子键;一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,按书写电子式要求分析;
(1)①H2O中只含共价键;②HClO中只含共价键;③NH4Cl中铵根离子和氯离子之间存在离子键,氮原子和氢原子之间存在共价键;④Na2O2中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键;⑤干冰中只含共价键;既存在离子键又存在共价键的是NH4Cl、Na2O2;
答案为③④;
(2)④Na2O2是由Na+和O22-组成,其电子式为![]() ;干冰为CO2,其结构式为O=C=C,因此CO2的电子式为
;干冰为CO2,其结构式为O=C=C,因此CO2的电子式为![]() ;
;
答案为![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,已知∶CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g),下列说法不正确的是( )
CO2(g)+3H2(g),下列说法不正确的是( )
A.0.1 mol CH3OH中含共价键数为0.5NA
B.10.0g 质量分数为32%的CH3OH溶液与4.6g的钠反应,产生H2分子数为0.1NA
C.1 mol CH3OH与足量的H2O反应,得到CO2分子数为NA
D.每消耗0.1 mol CH3OH时,转移电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用高分子吸附树脂提取卤水中的碘(主要以I-形式存在)的工艺流程如下
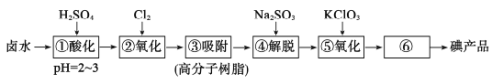
下列说法正确的是
A.流程中①和④所得溶液中,I-离子的浓度相等
B.流程中⑥的分离碘产品的操作方法是萃取
C.流程中④发生离子反应:2I2+SO![]() +H2O=4I-+SO
+H2O=4I-+SO![]() +2H+
+2H+
D.制备10mol I2,理论上需KC1O3的质量约为408g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究原电池产生电流的过程,设计了如图实验。
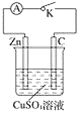
(1)打开K,观察到的现象为________________。
(2)关闭K,观察到的现象是_________。此电池的负极的电极反应式为_____。
(3)关闭K,溶液中阳离子向_______(填“Zn”或“C”)极移动,外电路中,电子流动方向是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是( )

A.a点所示的溶液中含有的溶质是NaOH和NaCl
B.b点所示的溶液能使紫色石蕊溶液变红
C.c点表示NaOH和稀盐酸恰好完全反应
D.a、b、c所示的溶液中都含有Na+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3 mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应初始时观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。
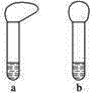
(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如上图所示,则试管b中反应的离子方程式为___________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,体积固定的密闭容器中,进行可逆反应A(s)+3B(g)![]() 3C(g),下列不能说明可逆反应达到平衡状态的是
3C(g),下列不能说明可逆反应达到平衡状态的是
A. B的浓度不再变化
B. 混合气体的压强不再变化
C. 混合气体的密度不再变化
D. 混合气体的平均相对分子质量不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com