
【题目】用高分子吸附树脂提取卤水中的碘(主要以I-形式存在)的工艺流程如下
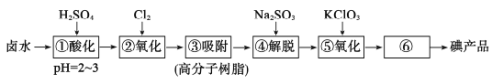
下列说法正确的是
A.流程中①和④所得溶液中,I-离子的浓度相等
B.流程中⑥的分离碘产品的操作方法是萃取
C.流程中④发生离子反应:2I2+SO![]() +H2O=4I-+SO
+H2O=4I-+SO![]() +2H+
+2H+
D.制备10mol I2,理论上需KC1O3的质量约为408g
【答案】D
【解析】
卤水中含碘离子,酸化后,通入氯气可氧化碘离子生成碘单质,高分子吸附树脂吸附碘单质,然后碘与亚硫酸钠发生氧化还原反应生成HI和硫酸钠,反应为I2+Na2SO3+H2O==2HI+Na2SO4,氧化时氯酸钾可氧化碘离子生成碘单质,离子反应为6I-+ClO3-+6H+=3I2+Cl-+2H2O,升华可得到粗产品,据此分析解答。
A.流程中①和④所得溶液中,碘离子的物质的量相同,为碘富集过程,浓度增大,c(I)后者大于前者,故A错误;
B.根据分析,对流程中⑥的分离碘产品进行升华操作进行分离,故B错误;
C.流程中④为碘与亚硫酸钠发生氧化还原反应生成HI和硫酸钠,离子反应:I2+SO32-+H2O=2I-+SO42-+2H+,故C错误;
D.根据氧化时氯酸钾可氧化碘离子生成碘单质,离子反应为6I-+ClO3-+6H+=3I2+Cl-+2H2O,制备10mol I2,理论上需KC1O3的物质的量为![]() mol,质量约为= 122.5g/mol×
mol,质量约为= 122.5g/mol×![]() mol≈408g,故D正确;
mol≈408g,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18.4 g 氢氧化钠和碳酸氢钠固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g。试计算原混合物中碳酸氢钠的质量分数。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠的途径如图所示:
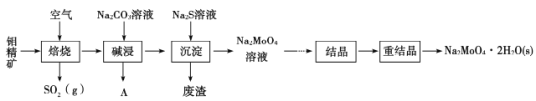
(1) Na2MoO4·2H2O中钼元素的化合价是____________
(2)焙烧过程发生的主要反应为MoS2+O2→MoO3+SO2(未配平),该反应的氧化产物是____________(填化学式)。
(3)碱浸时生成Na2MoO4和一种气体A,该气体的电子式为________;沉淀时加入Na2S溶液的目的是______________________
(4)焙烧钼精矿所用的装置是多层焙烧炉,图1为各炉层固体物料的物质的量的百分数(φ)。
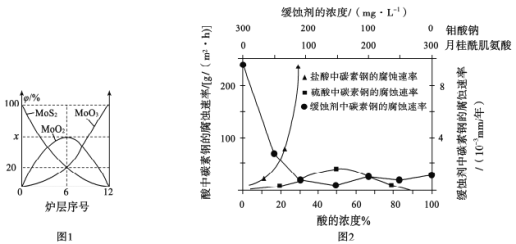
第6层焙烧炉中所得MoO3与MoO2的物质的量之比为___________
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图2:
①使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_______。
②随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是__________________________________。
③空气中钼酸盐对碳钢的缓蚀原理是在碳钢表面形成FeMnO4—Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需要加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应是在溶液中进行的反应,按下列要求作答:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用双线桥表示反应中电子的转移情况___;MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)该反应的氧化剂是___,发生了___反应。
(3)将其改写成离子方程式___。
(4)当有2molHCl消耗时,转移的电子的物质的量为___mol。
(5)浓盐酸在该反应中表现的性质是___(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器分别投入2molCO和1molO2。进行反应:2CO(g)+O2(g)![]() 2CO2(g)。在相同的时间段(5min)下,测得CO的转化率与温度的关系如图所示。下列说法正确的是
2CO2(g)。在相同的时间段(5min)下,测得CO的转化率与温度的关系如图所示。下列说法正确的是
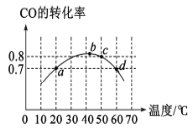
A.化学平衡常数:K(b)<K(c)<K(d)
B.a点,vO2(正)=0.14mo1·L-1·min-1
C.d点vCO(正)等于a点vCO(正)
D.50℃时,该反应的化学平衡常数K=160L·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O![]() )或-1g[c(H+)/c(HC2O
)或-1g[c(H+)/c(HC2O![]() )]和-lgc(C2O
)]和-lgc(C2O![]() )关系如图所示,下列说法错误的是
)关系如图所示,下列说法错误的是
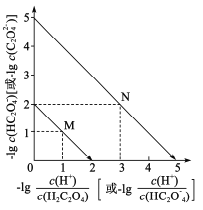
A.曲线M表示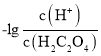 和
和![]() 的关系
的关系
B.滴定过程中,当pH=5时,c(Na+)-3c(HC2O![]() )>0
)>0
C.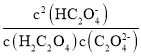 随pH的升高而减小
随pH的升高而减小
D.在NaHC2O4溶液中c(Na+)>(HC2O![]() )>c(C2O
)>c(C2O![]() )>c(H2C2O4)
)>c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列五种物质①H2O ②HClO ③NH4Cl ④Na2O2 ⑤干冰。
(1)既存在离子键又存在共价键的是__________。
(2)写出④的电子式_________,⑤的电子式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+3B(g)![]() 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.01mol/(L·s)B.v(B)=0.02mol/(L·s)
C.v(B)=0.60mol/(L·min)D.v(C)=1.00mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com