
【题目】下列反应是在溶液中进行的反应,按下列要求作答:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用双线桥表示反应中电子的转移情况___;MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)该反应的氧化剂是___,发生了___反应。
(3)将其改写成离子方程式___。
(4)当有2molHCl消耗时,转移的电子的物质的量为___mol。
(5)浓盐酸在该反应中表现的性质是___(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
【答案】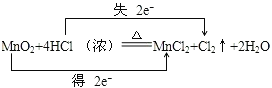 MnO2 还原 MnO2+2Cl-+4H+
MnO2 还原 MnO2+2Cl-+4H+![]() Mn2++2H2O+Cl2↑ 1 ②
Mn2++2H2O+Cl2↑ 1 ②
【解析】
反应MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑中,Mn元素化合价降低,被还原,
MnCl2+2H2O+Cl2↑中,Mn元素化合价降低,被还原,![]() 为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,
为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,![]() 为氧化产物,
为氧化产物,![]() 为还原产物,氧化剂与还原剂的物质的量之比为1:2,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为:
为还原产物,氧化剂与还原剂的物质的量之比为1:2,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为: ,
,
(1)用“双线桥”标明反应中电子的转移及数目为: ;故答案为:
;故答案为:![]()
 ;
;
![]() 该反应中氧化剂为二氧化锰,发生了还原反应,故答案为:
该反应中氧化剂为二氧化锰,发生了还原反应,故答案为:![]() ;还原;
;还原;
![]() 该反应的离子方程式为:MnO2+2Cl-+4H+
该反应的离子方程式为:MnO2+2Cl-+4H+![]() Mn2++2H2O+Cl2↑;故答案为:MnO2+2Cl-+4H+
Mn2++2H2O+Cl2↑;故答案为:MnO2+2Cl-+4H+![]() Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
![]() 当4molHCl消耗时,转移电子物质的量为2mol,则当有2molHCl消耗时转移电子物质的量为1mol;故答案为:1;
当4molHCl消耗时,转移电子物质的量为2mol,则当有2molHCl消耗时转移电子物质的量为1mol;故答案为:1;
![]() 浓盐酸在该反应中部分Cl化合价升高,体现出还原性,部分Cl化合价不变,与Mn2+形成盐,体现出酸性,则表现的性质是还原性和酸性,故②正确;故答案为:②。
浓盐酸在该反应中部分Cl化合价升高,体现出还原性,部分Cl化合价不变,与Mn2+形成盐,体现出酸性,则表现的性质是还原性和酸性,故②正确;故答案为:②。


科目:高中化学 来源: 题型:
【题目】为除去粗盐中的钙离子、镁离子、硫酸根离子及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
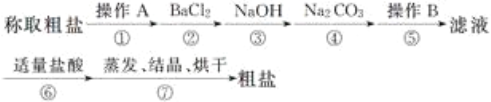
(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)____________________________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是_________________________。
(4)判断氯化钡已过量的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在自然界多以+1价存在于矿石中,在固态特别是高温下,+1价铜的化合物比+2价稳定。用辉铜矿(Cu2S)炼铜的方法如下:
(1)将辉铜矿在空气中高温焙烧,生成两种氧化物,反应的化学方程式是_____________。
(2)向焙烧得到的矿石中,再加上原矿石一半质量的未经焙烧过的矿石,混合后隔绝空气进行高温煅烧,得到金属铜和一种具有刺激性气味的气体,反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用天然气制取合成气,然后用合成气合成多种有机物是目前部分有机物的重要来源。
I.甲烷制取合成气时,在同一容器中同时发生的主要反应是:
反应①: CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H =+206.3 kJ mol-l
CO(g)+3H2(g) △H =+206.3 kJ mol-l
反应②: CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) △H =-802.6 kJmol-l
CO2(g)+2H2O(g) △H =-802.6 kJmol-l
(1)下列有关合成气制取的说法中正确的是_____。
A.升温时反应①的正反应速率增大,逆反应速率减小,平衡正向移动
B.反应②因为反应物和生成物的计量数相等,所以△S=0
C.反应②放出的热可以提供反应①所需的热量
D.在恒温恒容容器中,气体密度保持不变时,反应达到化学平衡状态
(2)在制取合成气的初始阶段,反应②的反应速率大于反应①的反应速率,请用碰撞理论解释原因______。
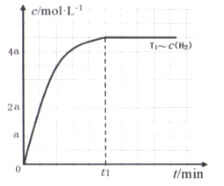
(3)在某密闭容器中加入一定量的CH4、H2O,在温度为T1时发生反应①,t1时达到化学平衡状态,氢气浓度[c(H2)]随时间(t)的变化如图。控制其它条件不变,在温度为T2时(T2<T1)发生反应,在图中画出c(CO)变化曲线_____。
II.合成己烷时发生的反应是∶
主反应:反应③6CO(g)+13H2(g)![]() C6H14(g)+6H2O(g) △H
C6H14(g)+6H2O(g) △H
副反应:反应④CO(g)+ H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
反应⑤2CO(g)![]() CO2(g)+C(s)
CO2(g)+C(s)
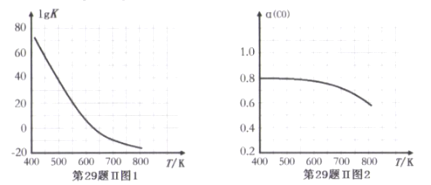
反应③的平衡常数的对数(lgK)随温度(T/K)的变化如图1,在固定的氢碳比[m(H2)/m(CO)]条件下CO的平衡转化率[a(CO)]随温度变化的曲线如图2.
请回答∶
(1)反应③的△H______0 (填“>”“="或“<")
(2) 600K前随温度升高反应③的平衡转化率几乎不变,结合图1说明原因(副反应影响可忽略)_____。
(3)工业生产需要选择适合的条件提高综合效益,下列对工业合成已烷的说法中正确的是(______)
A.减少体系中的水蒸气,有利于提高生产效益
B.在体系中加入并保持一定量的二氧化碳有利于减少副反应的发生
C.在体系中加入并保持一定量的碳有利于工业合成已烷
D.工业生产中,选择的压强越高越有利于提高综合效益
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定条件下,下列各组离子一定能大量共存的是
A.滴加甲基橙显红色的溶液中:Na+、Fe2+、C1-、NO![]()
B.0.1mol·L-1FeC13溶液中:NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、NO
、NO![]()
C.0.1mo1·L-1KI溶液中:Na+、K+、ClO-、OH-
D.由水电离的c(H+)=1.0×10-13 mo1·L-1的溶液中:K+、NH![]() 、C1-、HCO
、C1-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用高分子吸附树脂提取卤水中的碘(主要以I-形式存在)的工艺流程如下
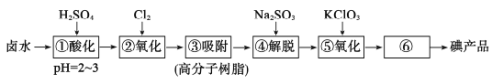
下列说法正确的是
A.流程中①和④所得溶液中,I-离子的浓度相等
B.流程中⑥的分离碘产品的操作方法是萃取
C.流程中④发生离子反应:2I2+SO![]() +H2O=4I-+SO
+H2O=4I-+SO![]() +2H+
+2H+
D.制备10mol I2,理论上需KC1O3的质量约为408g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g)pC(g)+qD(g)已知:平均反应速率v(C)=![]() v(A);反应2 min时,A的浓度减少了
v(A);反应2 min时,A的浓度减少了![]() a mol,B的物质的量减少了
a mol,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,v(A)=________,v(B)=________。
(2)化学方程式中,x=________,y=________,p=________,q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是( )

A.a点所示的溶液中含有的溶质是NaOH和NaCl
B.b点所示的溶液能使紫色石蕊溶液变红
C.c点表示NaOH和稀盐酸恰好完全反应
D.a、b、c所示的溶液中都含有Na+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
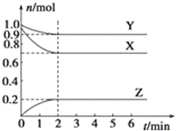
(1)该反应的化学方程式为:____。
(2)反应开始至2min,用X表示的平均反应速率为_____。
(3)反应开始至2min时,Y的转化率为___。
(4)对于上述反应当改变下列条件时,反应速率会发生什么变化(填“增大”、“减小” 或“不变”)?
①降低温度:_____;
②保持容器的体积不变,增加X的物质的量:____;
③保持容器的体积不变,增加He:____;
④增大容器的体积:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com