
【题目】利用天然气制取合成气,然后用合成气合成多种有机物是目前部分有机物的重要来源。
I.甲烷制取合成气时,在同一容器中同时发生的主要反应是:
反应①: CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H =+206.3 kJ mol-l
CO(g)+3H2(g) △H =+206.3 kJ mol-l
反应②: CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) △H =-802.6 kJmol-l
CO2(g)+2H2O(g) △H =-802.6 kJmol-l
(1)下列有关合成气制取的说法中正确的是_____。
A.升温时反应①的正反应速率增大,逆反应速率减小,平衡正向移动
B.反应②因为反应物和生成物的计量数相等,所以△S=0
C.反应②放出的热可以提供反应①所需的热量
D.在恒温恒容容器中,气体密度保持不变时,反应达到化学平衡状态
(2)在制取合成气的初始阶段,反应②的反应速率大于反应①的反应速率,请用碰撞理论解释原因______。
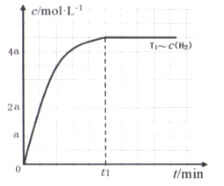
(3)在某密闭容器中加入一定量的CH4、H2O,在温度为T1时发生反应①,t1时达到化学平衡状态,氢气浓度[c(H2)]随时间(t)的变化如图。控制其它条件不变,在温度为T2时(T2<T1)发生反应,在图中画出c(CO)变化曲线_____。
II.合成己烷时发生的反应是∶
主反应:反应③6CO(g)+13H2(g)![]() C6H14(g)+6H2O(g) △H
C6H14(g)+6H2O(g) △H
副反应:反应④CO(g)+ H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
反应⑤2CO(g)![]() CO2(g)+C(s)
CO2(g)+C(s)
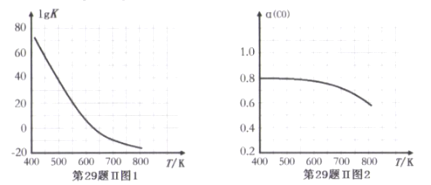
反应③的平衡常数的对数(lgK)随温度(T/K)的变化如图1,在固定的氢碳比[m(H2)/m(CO)]条件下CO的平衡转化率[a(CO)]随温度变化的曲线如图2.
请回答∶
(1)反应③的△H______0 (填“>”“="或“<")
(2) 600K前随温度升高反应③的平衡转化率几乎不变,结合图1说明原因(副反应影响可忽略)_____。
(3)工业生产需要选择适合的条件提高综合效益,下列对工业合成已烷的说法中正确的是(______)
A.减少体系中的水蒸气,有利于提高生产效益
B.在体系中加入并保持一定量的二氧化碳有利于减少副反应的发生
C.在体系中加入并保持一定量的碳有利于工业合成已烷
D.工业生产中,选择的压强越高越有利于提高综合效益
【答案】C 反应②的活化能较反应①的小,单位体积内活化分子百分数较大,有效碰撞次数较多,反应速率较快 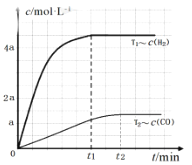 < 反应③的平衡常数K在600K前虽然随温度升高下降,但仍然很大,平衡转化率降低很小。 AB
< 反应③的平衡常数K在600K前虽然随温度升高下降,但仍然很大,平衡转化率降低很小。 AB
【解析】
从温度影响化学反应速率的角度分析。熵变等于0是混乱度不变的反应。反应②放热,反应①吸热,同一容器中同时发生反应②和反应①,反应②为反应①提供热量。根据平衡判据判断反应是否处于化学平衡状态。根据活化能的大小和单位体积活化分子百分数分析。温度降低,达到平衡的时间延长,平衡向放热的方向移动,逆向移动。根据图像中化学平衡常数随温度的变化判断反应放热还是吸热,并考虑转化率的影响。从平衡移动的方向考虑,然后分析。
I.(1) A.升温时反应①的正反应速率增大,逆反应速率也增大,正反应方向为吸热的反应,故温度升高,平衡正向移动,故A错误;
B.反应②因为反应物和生成物都是气体,气体的混乱度没有发生变化,所以△S=0,故B错误;
C.反应②和反应①在同一体系中,反应②放出的热可以提供反应①所需的热量,故C正确;
D.在恒温恒容容器中,气体密度始终不变,故不能判断反应达到化学平衡状态,故D错误;
答案选C。
(2)在制取合成气的初始阶段,反应②的活化能较反应①的小,单位体积内活化分子百分数较大,有效碰撞次数较多,反应速率较快,反应②的反应速率大于反应①的反应速率;
(3) 图中可以看出反应①在t1时刻达到化学平衡,根据反应CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H =+206.3 kJ mol-l,可知,CO和H2的浓度的变化量之比为1:3,H2和CO都是生成物,起始浓度都是0,H2的平衡浓度为4.5a,T2时CO的平衡浓度为1.5a,则T2<T1时,温度降低时,达到平衡时的时间延长,平衡逆向移动,T2时CO的平衡浓度小于1.5a, c(CO)变化曲线为:
CO(g)+3H2(g) △H =+206.3 kJ mol-l,可知,CO和H2的浓度的变化量之比为1:3,H2和CO都是生成物,起始浓度都是0,H2的平衡浓度为4.5a,T2时CO的平衡浓度为1.5a,则T2<T1时,温度降低时,达到平衡时的时间延长,平衡逆向移动,T2时CO的平衡浓度小于1.5a, c(CO)变化曲线为: ;
;
II.(1)lgK随温度的升高而降低,K值越大,平衡正反应方向进行的程度越大,在固定的氢碳比[m(H2)/m(CO)]条件下CO的平衡转化率[a(CO)]随温度的升高而降低,说明温度升高,平衡逆向移动,逆反应方向为吸热反应,反应③的△H<0;
(2) 600K前随温度升高反应③的平衡转化率几乎不变,根据图1,反应③的平衡常数K在600K前虽然随温度升高下降,但仍然很大,平衡转化率降低很小;
(3) 根据反应,主反应:反应③6CO(g)+13H2(g)![]() C6H14(g)+6H2O(g) △H
C6H14(g)+6H2O(g) △H
副反应:反应④CO(g)+ H2O(g)![]() CO2(g)+H2(g);
CO2(g)+H2(g);
A.减少体系中的水蒸气,平衡正向移动,有利于提高生产效益,故A正确;
B.在体系中加入并保持一定量的二氧化碳,会使副反应的生成物浓度增大,使平衡逆向移动,有利于减少副反应的发生,故B正确;
C.碳是固体,在体系中加入并保持一定量的碳对平衡没有影响,故C错误;
D.工业生产中,本反应正反应方向是体积减小的反应,压强越高,越有利于提高产率,选择的压强越高,对设备的要求较高,增加了成本,不一定提高综合效益,故D错误;
答案选AB。


科目:高中化学 来源: 题型:
【题目】芜湖市某便利店销售的一种食用碘盐包装袋上有如下标签:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式:____KIO3+____KI+____H2SO4=____K2SO4+_____I2+____H2O
(2)实验室可分离获取单质碘,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把适量碘水和CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开;
H.静置、分层;
①正确的操作顺序是(用编号字母填写)____→____ → ___→A → __→ ___→E→F。
②下列物质,不能作为从水溶液中萃取碘的溶剂是____。
A.苯 B.汽油 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。理论上Na2SO3与I2反应的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了对锂离子电池研发作出卓越贡献的三位科学家。南开大学李福军研究团队以C3N4作为Li-O2可充电电池的光电极,提升了电池的能量效率,其充电工作原理如图所示。下列说法不正确的是( )
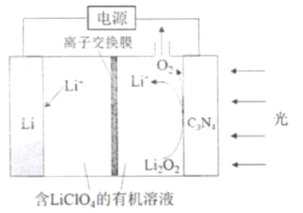
A.离子交换膜为阳离子交换膜
B.放电时,Li+移向Li电极
C.放电时,Li电极为负极,发生氧化反应
D.充电时,光电极的电极反应式为∶ Li2O2-2e-= 2Li++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18.4 g 氢氧化钠和碳酸氢钠固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g。试计算原混合物中碳酸氢钠的质量分数。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上常用CO与H2合成甲醇,热化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-574.4 kJ·mol-1。
CH3OH(g) ΔH=-574.4 kJ·mol-1。
(1)下图是表示一定温度下,在体积为2L的密闭容器中加入5mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。反应第10分钟达到平衡,从反应开始到平衡,用H2表示平均反应速率v(H2)=__mol/(L·min),且反应前后体系的压强之比为____。
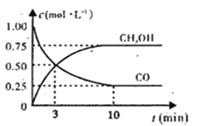
(2)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
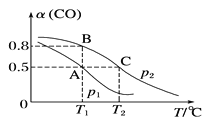
①A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠的途径如图所示:
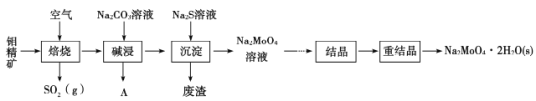
(1) Na2MoO4·2H2O中钼元素的化合价是____________
(2)焙烧过程发生的主要反应为MoS2+O2→MoO3+SO2(未配平),该反应的氧化产物是____________(填化学式)。
(3)碱浸时生成Na2MoO4和一种气体A,该气体的电子式为________;沉淀时加入Na2S溶液的目的是______________________
(4)焙烧钼精矿所用的装置是多层焙烧炉,图1为各炉层固体物料的物质的量的百分数(φ)。
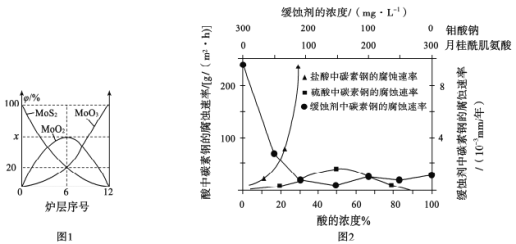
第6层焙烧炉中所得MoO3与MoO2的物质的量之比为___________
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图2:
①使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_______。
②随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是__________________________________。
③空气中钼酸盐对碳钢的缓蚀原理是在碳钢表面形成FeMnO4—Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需要加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应是在溶液中进行的反应,按下列要求作答:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用双线桥表示反应中电子的转移情况___;MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)该反应的氧化剂是___,发生了___反应。
(3)将其改写成离子方程式___。
(4)当有2molHCl消耗时,转移的电子的物质的量为___mol。
(5)浓盐酸在该反应中表现的性质是___(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O![]() )或-1g[c(H+)/c(HC2O
)或-1g[c(H+)/c(HC2O![]() )]和-lgc(C2O
)]和-lgc(C2O![]() )关系如图所示,下列说法错误的是
)关系如图所示,下列说法错误的是
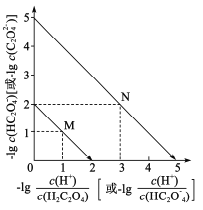
A.曲线M表示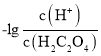 和
和![]() 的关系
的关系
B.滴定过程中,当pH=5时,c(Na+)-3c(HC2O![]() )>0
)>0
C.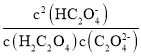 随pH的升高而减小
随pH的升高而减小
D.在NaHC2O4溶液中c(Na+)>(HC2O![]() )>c(C2O
)>c(C2O![]() )>c(H2C2O4)
)>c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是
2H2(g)+O2(g)==2H2O(l)
(l)请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点______________________。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com