
【题目】2019年诺贝尔化学奖颁给了对锂离子电池研发作出卓越贡献的三位科学家。南开大学李福军研究团队以C3N4作为Li-O2可充电电池的光电极,提升了电池的能量效率,其充电工作原理如图所示。下列说法不正确的是( )
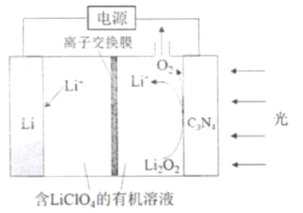
A.离子交换膜为阳离子交换膜
B.放电时,Li+移向Li电极
C.放电时,Li电极为负极,发生氧化反应
D.充电时,光电极的电极反应式为∶ Li2O2-2e-= 2Li++O2↑
科目:高中化学 来源: 题型:
【题目】中华传统文化蕴含着很多科学知识。下列说法错误的是( )。
A.“水声冰下咽,沙路雪中平”未涉及化学变化
B.《吕氏春秋·别类编》中“金(即铜)柔锡柔合两柔则刚”体现了合金硬度方面的特性
C.“司南之(勺),投之于地,其柢(柄)指南”。司南中“杓”所用材质为![]()
D.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”里的“碱”是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的钙离子、镁离子、硫酸根离子及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
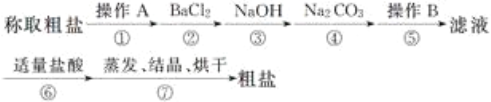
(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)____________________________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是_________________________。
(4)判断氯化钡已过量的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) ![]() 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A.1mol B和1mol CB.2mol A、3mol B和1mol He(He不参加反应)
C.2mol CD.2mol A、3mol B和3mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于工业制备方法与化学方程式均正确的是( )
A.工业上用电解饱和食盐水的方法制取氯气:2NaCl![]() 2Na + Cl2↑
2Na + Cl2↑
B.工业上用乙醇在浓硫酸的作用下制取乙烯: CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
C.工业上用氢气还原四氯化硅制得高纯度的硅:SiCl4+2H2![]() Si+4HCl
Si+4HCl
D.工业以硫黄为原料生产硫酸,沸腾炉中的主要反应: 2S+3O2![]() 2SO3
2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,已知∶CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g),下列说法不正确的是( )
CO2(g)+3H2(g),下列说法不正确的是( )
A.0.1 mol CH3OH中含共价键数为0.5NA
B.10.0g 质量分数为32%的CH3OH溶液与4.6g的钠反应,产生H2分子数为0.1NA
C.1 mol CH3OH与足量的H2O反应,得到CO2分子数为NA
D.每消耗0.1 mol CH3OH时,转移电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在自然界多以+1价存在于矿石中,在固态特别是高温下,+1价铜的化合物比+2价稳定。用辉铜矿(Cu2S)炼铜的方法如下:
(1)将辉铜矿在空气中高温焙烧,生成两种氧化物,反应的化学方程式是_____________。
(2)向焙烧得到的矿石中,再加上原矿石一半质量的未经焙烧过的矿石,混合后隔绝空气进行高温煅烧,得到金属铜和一种具有刺激性气味的气体,反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用天然气制取合成气,然后用合成气合成多种有机物是目前部分有机物的重要来源。
I.甲烷制取合成气时,在同一容器中同时发生的主要反应是:
反应①: CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H =+206.3 kJ mol-l
CO(g)+3H2(g) △H =+206.3 kJ mol-l
反应②: CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) △H =-802.6 kJmol-l
CO2(g)+2H2O(g) △H =-802.6 kJmol-l
(1)下列有关合成气制取的说法中正确的是_____。
A.升温时反应①的正反应速率增大,逆反应速率减小,平衡正向移动
B.反应②因为反应物和生成物的计量数相等,所以△S=0
C.反应②放出的热可以提供反应①所需的热量
D.在恒温恒容容器中,气体密度保持不变时,反应达到化学平衡状态
(2)在制取合成气的初始阶段,反应②的反应速率大于反应①的反应速率,请用碰撞理论解释原因______。
(3)在某密闭容器中加入一定量的CH4、H2O,在温度为T1时发生反应①,t1时达到化学平衡状态,氢气浓度[c(H2)]随时间(t)的变化如图。控制其它条件不变,在温度为T2时(T2<T1)发生反应,在图中画出c(CO)变化曲线_____。
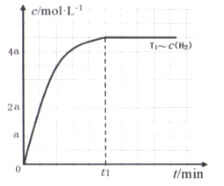
II.合成己烷时发生的反应是∶
主反应:反应③6CO(g)+13H2(g)![]() C6H14(g)+6H2O(g) △H
C6H14(g)+6H2O(g) △H
副反应:反应④CO(g)+ H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
反应⑤2CO(g)![]() CO2(g)+C(s)
CO2(g)+C(s)
反应③的平衡常数的对数(lgK)随温度(T/K)的变化如图1,在固定的氢碳比[m(H2)/m(CO)]条件下CO的平衡转化率[a(CO)]随温度变化的曲线如图2.
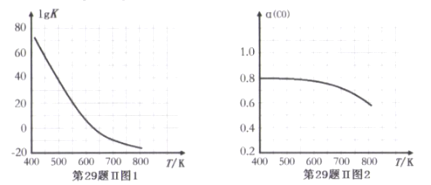
请回答∶
(1)反应③的△H______0 (填“>”“="或“<")
(2) 600K前随温度升高反应③的平衡转化率几乎不变,结合图1说明原因(副反应影响可忽略)_____。
(3)工业生产需要选择适合的条件提高综合效益,下列对工业合成已烷的说法中正确的是(______)
A.减少体系中的水蒸气,有利于提高生产效益
B.在体系中加入并保持一定量的二氧化碳有利于减少副反应的发生
C.在体系中加入并保持一定量的碳有利于工业合成已烷
D.工业生产中,选择的压强越高越有利于提高综合效益
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是( )

A.a点所示的溶液中含有的溶质是NaOH和NaCl
B.b点所示的溶液能使紫色石蕊溶液变红
C.c点表示NaOH和稀盐酸恰好完全反应
D.a、b、c所示的溶液中都含有Na+、Cl﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com